高三年级化学上学期期末考试试题
化 学 试 题
命题学校:鞍山一中 命题人:曹书楷 校对人:高三备课组
可能用到的相对原子质量:Cl-35.5 S-32 N-14 H-1 C-12
O-16 Fe-56 Ag-108 Na-23
第Ⅰ卷(共45分)
一、选择题( 共15小题,每小题只有一个正确答案,每小题3分共45分)
1.下列有关叙述中,不正确的是 ( )
A.可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康危害极大
B.开发利用绿色能源(例如太阳能)替代化石燃料是人类可持续发展的必由之路
C.皮肤上不慎沾了苯酚,应立即用酒精清洗
D.石油蒸馏实验中,温度计必须插入液体中部
2.少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变 H2 的产量,可以使用如下方法中的 ( )
①加H2O ②加NaOH 固体③滴入几滴浓盐酸④加CH3COONa 固体⑤加NaCl 溶液
⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用10mL 0.1mol/L盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.⑤⑥⑧
3.已知2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;下列叙述不正确的是( )
A.实验室中不能用盐酸来酸化高锰酸钾
B.利用该反应制取氯气时,与用二氧化锰和浓盐酸制氯气实验装置完全相同
C.结合已有知识可以判断氧化性强弱顺序为:MnO4->MnO2>Cl2>Fe3+
D.该反应中1mol还原剂失去1mol电子
4.下列离子一定能够大量共存的是 ( )
A.Na+、Al3+、Cl-、HCO3- B.Na+、OH-、NH4+、Ba2+
C.H3O+、NO3-、Fe2+、Na+ D.K+、AlO2-、NO3-、OH-
5.能正确表示下列化学反应的离子方程式是 ( )
A.饱和石灰水跟稀硝酸反应 Ca(OH)2+2H+= Ca2++2H2O
B.硫酸铝溶液加过量的氢氧化钠 Al3+ + 3OH- = Al(OH)3↓
C.将硫酸氢钠滴加到氢氧化钡溶液中至溶液呈中性
Ba2++2OH-+2H++SO42-= BaSO4↓+ 2H2O
D.用大理石与盐酸制取二氧化碳:CO32-+2H+=H2O+CO2↑
6.用NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.1mol -OH(羟基)中含有电子数为9NA
B.1 L 1mol/L 的氯化铁溶液中含有铁离子的数目为NA
C.7.1g氯气与足量氢氧化钠溶液反应转移的电子数为0.2NA
D.标准状况下,11.2 L SO3所含的分子数为0.5NA
7.室温时,向体积为V1、浓度为c1、pH=a的CH3COOH溶液中加入体积为V2、浓度为c2、pH=b的NaOH溶液,充分反应。下列关于反应后混合液的叙述一定正确的是 ( )
A.若pH=7,且V1=V2,则c1>c2
B.若pH<7,则c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.若c1=c2,且V1=V2,则a+b=14
D.若pH>7,且V1=V2,则c1<c2
8.几种短周期元素的原子半径及主要化合价见下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列叙述正确的是 ( )
A.L、R的单质与稀盐酸反应R比L更剧烈
B.M与T形成的化合物有两性
C.Q、T两元素的氢化物稳定性Q>T
D.L与T形成化合物固态时是原子晶体
9.下列操作中错误的是
A.除去乙醇中的少量水:加入无水硫酸铜,再蒸馏
B.除去苯中的少量苯酚:加入NaOH溶液,振荡、静置、分液
C.除去CO2中的少量SO2:通过盛有饱和NaHCO3溶液的洗气瓶
D.除去FeCl2溶液中的少量FeCl3:加入Fe粉,过滤
|
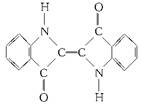
A.靛蓝由碳、氢、氧、氮四种元素组成
B.它的分子式是C16H10N2O2
C.该物质苯环上的一溴代物有2种
D.1mol靛蓝最多可与9mol氢气加成
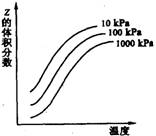 11.右图是温度和压强对X+2Y
11.右图是温度和压强对X+2Y![]() 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
( )
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
( )
A.增大压强,平衡正向移动
B.X和Z一定为气态
C.X可能为气态
D.上述反应的逆反应的△H<0
12.不能用勒沙特列原理解释的是 ( )
A.NaOH溶液使酯水解比稀H2SO4使酯水解效果更好
B.饱和FeCl3溶液中加入盐酸,丁达尔效应减弱
C.乙酸乙酯水解时加入稀硫酸
D.氨水的保存需要密封、低温保存
| |
A.与乙酸发生酯化反应 B.与NaOH水溶液共热
C.与银氨溶液作用 D.在催化剂存在下与氢气作用
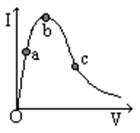 14.一定温度下,冰醋酸加水稀释的过程中,溶液导电能力(I)随加水的体积(V)变化如图所示,下列说法正确的是 ( )
14.一定温度下,冰醋酸加水稀释的过程中,溶液导电能力(I)随加水的体积(V)变化如图所示,下列说法正确的是 ( )
A.“O”点导电能力为0的理由是冰醋酸是固体,
内部的离子不能自由移动
B.a、b、c三点中,a点c(H+)最大,因为电解
质溶液浓度越大,离子浓度就越大
C.a、b、c三点中,b点水电离的程度最大
D.若使b点处溶液中c(H+)减小,可向溶液中加水或加冰醋酸
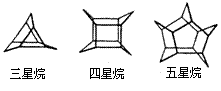 15.化学家们合成了如下图所示的一系列的星烷,如三星烷、四星烷、五星烷等。下列说法不正确的是 ( )
15.化学家们合成了如下图所示的一系列的星烷,如三星烷、四星烷、五星烷等。下列说法不正确的是 ( )
A.它们之间互为同系物
B.三星烷的化学式为C9H12
C.三星烷与丙苯互为同分异构体
D.它们的一氯代物均只有两种
第Ⅱ卷(共55分)
16.(8分)
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:
(2)水的电离方程式:H2O +
H2O![]() H3O++OH- ,若液态肼能够按照类似方式电离,请写出电离方程式:
H3O++OH- ,若液态肼能够按照类似方式电离,请写出电离方程式:
(3)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
(4)肼(N2H4)与过氧化氢、乙烷分子量相近,且均为非金属氢化物,但乙烷与前两者沸点相差较大。其原因为
17.(12分)有一类无机化合反应的通式可以表示为:单质+化合物(1)=化合物(2)
请写出满足以下要求的4个此类无机化合反应的化学方程式:
① 所涉及的元素的原子序数都小于30;② 4种单质分属4个不同族。
(1)
(2)
(3)
(4)
18.(9分)请回答(1)和(2)两小题
(1)下列说法正确的是 (选填序号)
A.在进行物质检验时,一般先对试样进行外观观察,确定其状态、颜色、气味等
B.配制银氨溶液时,应把硝酸银溶液逐滴加入氨水中
C.一般在实验室点燃可燃性气体时,必须先要检验纯度
D.测定硫酸铜晶体结晶水的质量分数时,若用潮湿的坩埚会使测定结果偏小
| |
F.实验室制取氯气等有毒气体时,必须在密闭体系或通风橱中进行
(2)补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
① 配制0.01mol/L到0.008mol/L等一系列浓度的[Fe(SCN)6]3-(红色)溶液作为标准比色液
② 样品处理:
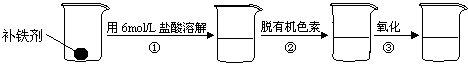
③ 准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10mL。
④ 比色:选取与待测液颜色一致或相近的标准比色液即可判断待测液的浓度。
试回答下列问题:
①配制100mL0.01mol/L标准溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要: 、 。
②步骤②脱色过程包括加入: (填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→ (填操作)。
③步骤②样品处理中,氧化的目的是
____________________________________________________________________
|
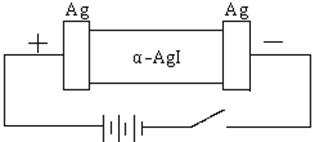
(1)铅蓄电池的正极电极方程式:(已知硫酸铅为难溶物)
(2)若Ag+导电,α-AgI本身质量将 。(填不变、变大、或变小)
电解池的阳极电极方程式:
若I-导电,阳极附近的α-AgI晶体密度将会 。(填不变、变大、或变小)
(3)若通电一段时间后铅蓄电池中消耗了1molH2SO4,则电解池的阴极增重 g。20.(10分)在有机分析中,常用臭氧氧化分解来确定有机物中碳碳双键的位置与数目。
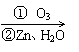 如:(CH3)2C=CH-CH3
(CH3)2C=O+CH3CHO
如:(CH3)2C=CH-CH3
(CH3)2C=O+CH3CHO
且已知:CH2=CH-OH(烯醇式结构:碳碳双键连接羟基)不能稳定存在
已知某有机物A经臭氧氧化分解后发生下列一系列的变化:
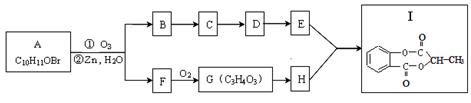
试回答下列问题:
(1)F可能的结构有两种,请写出结构简式 、 。
(2)从B合成E通常要经过几步有机反应,其中最佳的次序应是 。
A.水解、酸化、氧化 B.氧化、水解、酸化
C.水解、酸化、还原 D.氧化、水解、酯化
(3)G制取H的化学方程式:
指明反应类型:
21.(6分)A、B、C、D、E、F、G、H为化合物。甲、乙、丙均为中学化学中常见单质,甲、乙为固体,丙为气体;C、E是化学工业重要产品。
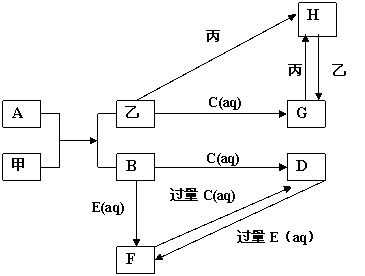

(1)乙在周期表中的位置 ;写出一个A与甲可能的反应方程
式: ;
(2) 请写出下列反应的离子方程式G→H
参 考 答 案
1.D 2.C 3.B 4.D 5.C 6.A 7.A 8.B 9.A 10.C 11.B
12.C 13.C 14.D 15.A
16.(1)N2H4(1)+O2(g)=N2(g)+2H2O(l);△H=-624kJ/mol (2分)
(2) N2H4 + N2H4![]() N2H5+ + N2H3-(2分)
N2H5+ + N2H3-(2分)
(3)ClO-+2NH3=N2H4+Cl-+H2O(2分)
(4)肼、过氧化氢分子间能够形成氢键,沸点升高(2分)
17.O2+2NO=2NO2 ; Cl2+2FeCl2=2FeCl3 ; Fe+2FeCl3=3 FeCl2 ;
C + CO2![]() 2CO(其它合理答案也行,每个3分,少条件者扣1分)
2CO(其它合理答案也行,每个3分,少条件者扣1分)
18.(1) A C F ( 3分,对一个得1分,错一个扣1分,扣完为止)
(2)① 100mL容量瓶、胶头滴管(共2分) ② 活性炭、过滤(共2分)
③ 使溶液中Fe2+ 离子全部转化为Fe3+,与SCN-反应显色(2分)
19.(1)PbO2+4H++SO42-+2e-=PbSO4+2H2O(2分)
(2)不变,Ag-e-=Ag+,变大(各2分,共6分) (3)108 (2分)
20.(1) CH3COCH2OH、CH3CH(OH)CHO(各2分,共4分)
(2)B(2分)
(3) CH3COCOOH+H2![]() CH3CHOHCOOH(2分)
CH3CHOHCOOH(2分)
加成反应或还原反应(1分)
21.(1)
第四周期,VIII族(各1分,共2分) Fe2O3+2Al![]() Al2O3+2Fe(2分)
Al2O3+2Fe(2分)
(2)2Fe2+ + Cl2 = 2Fe3+ + 2Cl-(2分)