高三化学能力统一测试试题
理科综合能力试卷
5.保护环境,人人有责。下列说法错误的是
A.倡导人们在购物时使用纸袋或布袋、最好不用塑料袋,是为了防止白色污染
B.对废电池集中处理是为防止电池中汞、镉、铅等重金属离子对土壤和水源的污染
C.北京地区空气污染指数的主要项目是:SO2、NO2、CO2及可吸入颗粒物
D.白口铁(镀锌铁)和马口铁(镀锡铁)比较,镀层被破坏后,马口铁更易被腐蚀
6.设NA为阿伏加德罗常数,下列说法不正确的是
A.用含0.01molFeCl3的饱和溶液制成的Fe(OH)3胶体中所含胶粒数小于0.01NA
B.标准状况下,22.4 L Cl2和HCl的混合气体中含分子数为NA
C.30 g甲醛中含有的共用电子对数为4NA
D.0.![]() 原子中含中子数为3.6NA
原子中含中子数为3.6NA
7.某溶液中大量存在五种离子:NO3-、SO42-、Fe3+、H+、X,其物质的量之比为:
n(NO3-):n(SO42-):n(Fe3+):n(H+) :n (X) = 2:3:1:3:1,则X可能为
A.Fe2+ B.Mg2+ C.Cl- D.Ba2+
8.已知0.1mol/L的二元酸H2A溶液的pH=4,则下列说法中不正确的是
A.在Na2A和NaHA溶液中离子种类相同
B.在溶质物质的量浓度相等的Na2A和NaHA溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2 c(A2-)
D.在Na2A溶液中一定有:c(OH-)=c(H+)+c(HA-)+2c(H2A)
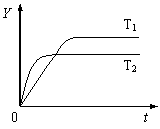 9.已知反应N2(g)+3H2(g)
9.已知反应N2(g)+3H2(g)![]() 2NH3(g);ΔH<0,向某体积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应。右图是某物理量(Y)随时间(t)变化的示意图,Y可以是
2NH3(g);ΔH<0,向某体积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应。右图是某物理量(Y)随时间(t)变化的示意图,Y可以是
A.N2的转化率 B.混合气体的密度
C.密闭容器的压强 D.H2的体积分数
10.下列叙述不正确的是
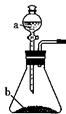 A.可用Ba(OH) 2溶液同时鉴别FeCl3、AlCl3、MgCl2、Fe(NO3)2、Na2SO4 五种溶液
A.可用Ba(OH) 2溶液同时鉴别FeCl3、AlCl3、MgCl2、Fe(NO3)2、Na2SO4 五种溶液
B.取1mol/LCuSO4溶液和0.5mol/LNaOH溶液各1mL,在一支洁净的试管内混合后,向其中又加入0.5mL40%的乙醛,加热后不会产生红色沉淀
C.用电石制取乙炔常因混有PH3、H2S等杂质而有特殊难闻的臭味
D.可用右图装置制取的气体有NO2、NH3、O2、CO2
11.工业上由二氧化锰制备KMnO4分两步进行:
① 二氧化锰与氢氧化钾共熔并通入O2:2MnO2 + 4KOH+O2![]() 2K2MnO4 + 2H2O
2K2MnO4 + 2H2O
② 电解锰酸钾溶液:2K2MnO4 + 2H2O![]() 2KMnO4+ H2↑+ 2KOH
2KMnO4+ H2↑+ 2KOH
根据上述内容,判断下列叙述正确的是
A.氧化性 K2MnO4 >O2
B.每生成1mol KMnO4共转移6mol电子
C.第②步电解时,阴极周围溶液的pH值减小
D.第②步电解时,KMnO4在阳极区生成
12.将某些化学知识用数轴表示,可以收到直观形象、简明易记的效果。用数轴表示的下列化学知识中,正确的是
A.常温条件下,酚酞的变色范围:![]()
B.分散系的分类:![]()
C.AlCl3和NaOH溶液反应后铝元素的存在形式:
![]()
D.CO2与NaOH溶液反应的产物:![]()
25.(16分)某有机物X(C12H13O6Br)遇到FeCl3溶液显紫色,其部分结构简式如下:
![]()
已知:X在足量的氢氧化钠水溶液中加热,可以得到A、B、C三种有机物。
(1)C中只有一种位置的氢原子。
(2)室温下A经盐酸酸化可以得到苹果酸E,E的结构简式为
![]() ,
,
试回答:
(1)B中所含官能团的名称是 。
(2)C的结构简式为 。
(3)E不能发生的反应类型是 (填序号)。
①加成反应 ②消去反应 ③氧化反应 ④酯化反应
(4)E的一种同分异构体F有如下特点:1molF可以和3mol金属钠发生反应,放出33.6LH2(标准状况下),1molF可以和足量NaHCO3溶液反应,生成1molCO2,1molF还可以发生银镜反应,生成2molAg。则F的结构简式可能是(只写一种)
。
(5)在一定条件下两分子E可以生成六元环酯,写出此反应的化学方程式:
。
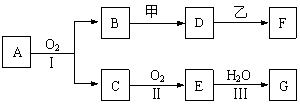 26.(14分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
26.(14分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
(1)若A为硫酸工业的重要原料,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应Ⅱ在 中进行(填设备名称),工业上反应Ⅲ用于吸收E的试剂是 。
②D的水溶液呈 性(填“酸”、“碱”或“中”)。
③反应Ⅰ的化学方程式是______________________________________________。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①甲的电子式是 。
②写出B和甲反应的化学方程式是______________________________________。
③若17 g A与O2反应生成气态的B和C时放出226.7 kJ热量,写出该反应的热化学方程式:___________________________________________________。
27.(14分)某化学兴趣小组的同学,在学习了高中化学第三册中有关草酸的性质,查阅了大量资料,获得了草酸的一些信息,整理出下表:
| (1) 草酸晶体 | 分子式 | H2C2O4·2H2O | 颜色 | 无色晶体 |
| 熔点 | 100.1℃ | 受热至100.1℃时失去结晶水,成为无水草酸。 | ||
| (2) 无水草酸 | 结构简式 | HOOC—COOH | 溶解性 | 能溶于水或乙醇 |
| 特性 | 大约在157℃升华(175℃以上发生分解)。 | |||
| 化学性质 | H2C2O4 + Ba(OH)2 =BaC2O4↓+ 2H2O | |||
| HOOC—COOH >175℃ CO2↑+CO↑+H2O↑ | ||||
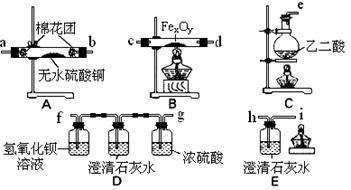 该组同学依据上表设计了一套如下图所示的实验装置,欲通过实验验证无水草酸受热分解的产物,并利用反应产生的CO气体来还原铁的某种氧化物(FexOy),以确定FexOy的组成。
该组同学依据上表设计了一套如下图所示的实验装置,欲通过实验验证无水草酸受热分解的产物,并利用反应产生的CO气体来还原铁的某种氧化物(FexOy),以确定FexOy的组成。
请回答下列问题:
(1)实验所需的仪器装置如上图所示,各装置的连接顺序为:
e接 、 接 、 接 、 接 h 。
(2)该组同学进行了下列实验操作:
① 点燃B处的酒精灯;
② 检查实验装置的气密性并装入药品;
③ 反应结束后,先熄灭B处的酒精灯,继续通入气体直到B中固体全部冷却后,再熄灭c处的酒精灯;
④ 点燃c处的酒精灯,开始反应,在装置E的i口处收集一试管气体,验纯;
⑤ 点燃尖嘴i处的酒精灯。
正确的实验操作顺序是: 。
(3)收集气体验纯的目的是 。
D装置中澄清石灰水的作用是 。
E装置中澄清石灰水的作用是 。
(4)反应完全后,该组同学进行数据处理。反应前,称得硬质玻璃管的质量为54.00 g,样品FexOy的质量为7.84 g;反应后,称得硬质玻璃管与剩余固体的总质量为59.60g(其质量经同样操作后也不再发生变化),则样品FexOy中,x:y= 。
(5)本实验有没有不妥之处?如果有,请答出改进的方案;若无,此问可不必答。
。
28.(16分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处。请用相应的化学用语回答下列问题:
| a | |||||||
| b |
|
| c | d | e | f | |
| g | h |
(1)写出仅由e形成的两种带有相同电荷数的阴离子的符号: 、 。
(2)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式 。
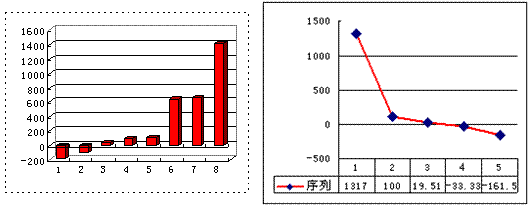
(3)上左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表 。(填化学式)
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物的名称是 ,序列“2”的氢化物的结构式为 。
(5)单质a和单质e可以设计为新型燃料电池,电解质为KOH溶液,则单质a在该
燃料电池的______极发生电极反应,电极反应式为 。
参考答案
| 题号 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | C | D | B | B | A | A | D | D |
化学题(Ⅱ卷)答案
25.(16分)(1)羟基………………………………………………………………(3分)
(2)![]() ………………………………………………………(3分)
………………………………………………………(3分)
(3)① …………………………………………………………………………(3分)
(4)![]() 或
或
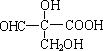 ……………………(3分)
……………………(3分)
(5)![]()
![]()
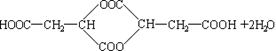
………………………………………………………………………………(4分)
26.(14分)
(1)①接触室…………(2分) 98.3%的硫酸(或浓硫酸)……………(2分)
②酸………………(2分)
③4FeS2+11O2![]() 2Fe2O3+8SO2………………………………………(2分)
2Fe2O3+8SO2………………………………………(2分)
(2)① ![]() ………………………………………………………(2分)
………………………………………………………(2分)
② 2Na2O2+2H2O=4NaOH+O2↑……………………………………… (2分)
③ 4NH3(g)+5O2(g)=4NO(g)+6H2O(g);ΔH=-906.8 kJ·mol-1(其它合理答案均给分)………………………………………………………………(2分)
27.(14分)(1)a bf gc d或b af gd c(其它合理答案均给分)…………………(2分)
(2)②④⑤①③ ………………………………………………………………(2分)
(3)防止装置中空气与CO的混合气受热时发生爆炸;……………………(2分)
检验CO2是否已除净;……………………………………………………(2分)
证明有新的CO2生成,并说明乙二酸分解产物中有CO ………………(2分)
(4)5:7 …………………………………………………………………………(2分)
(5)在装置A与D之间加一个装有一定量水(或乙醇)的洗气瓶。(说明:A、D之间缺少一个吸收草酸蒸汽装置,草酸也可以使氢氧化钡溶液变浑浊)…(2分)
28.(16分)(1)O2- ……………(2分) O22-(或O2-、O3-)………………(2分)
(2)2OH—+2Al+2H2O=2AlO2—+3H2↑ ……………………………………(2分)
(3)Si ……………………………………………………………………………(2分)
(4)甲烷……………………(2分) H—O—H ………………………(2分)
(5)负……(2分) H2+2OH—-2e—==2H2O(其它合理答案均给分)……(2分)