高三化学质检试题
注意事项:
1. 本试卷分选择题和 非选择题二部分,共计150分, 考试时间为120分钟。
2.答题时,选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,没有答题卡的将答案填在答题卷对应题目的表格内或空格内。
3.可能用的相对原子质量:H: 1 O:16 C : 12 Cl:35.5 Ca:40 Mn:55
第一部分 选择题 (共70分)
一、选择题(本题包括10小题,每小题3分,共30分,每小题只有一个选项符合题意)
1.2005年6月5日是第34个世界环境日,联合国环境署确定的活动主题是“营造绿色城市,呵护地球家园”,下列措施不符合这一主题的是 ﹙ ﹚
A.推广垃圾分类存放,分类回收,分类处理
B.改革传统采煤时将煤层瓦斯气(主要成分甲烷)直接排入空气的做法,采用先开采和综合利用煤层瓦斯气,然后再采煤的方法
C. 推广使用液化石油气(LPG)替代汽油和柴油作公交车和出租车的燃料
D.将工厂的烟囱造高,以减少工厂周围的大气污染
2.目前人类已发现的非金属元素除稀有气体外共有16种,下列对这16种非金属元素的相关判断 ( )
①都是主族元素,最外层电子数都大于4 ②单质在反应中都只能作氧化剂
③氢化物常温下都是气态,所以又都叫气态氢化物 ④氧化物常温下都可以与水反应生成酸
A.只有①②正确 B.只有①③正确 C.只有④正确 D.①②③④均不正确
3.下列说法一定正确的是 ( )
A.Na2O2固体中阳离子和阴离子的个数比为2:1
B.在晶体中只有阳离子,就一定有阴离子
C.非金属元素呈现的负化合价,其绝对值等于该元素原子的最外层电子数
D.元素周期表中L层为偶数的所有元素所在族的序数与该元素原子的L层电子数相等
4.研究表明:H2O2具有立体结构,两个氢原子像在半展开一本书的两页上,两页纸面的夹角为94°,氧原子在书的夹缝上,O—H键与O—O键之间的夹角为97°。下列说法错误的是 ( )
A.H2O2分子的结构式:H-O-O-H B.H2O2分子中既含有极性键又含有非极性键
C.H2O2分子为非极性分子 D.H2O2为极性分子
5.α1和α2分别为A在两个恒容容器中平衡体系A(g)![]() 2B(g)和2A(g)
2B(g)和2A(g)![]() B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
( )
B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
( )
A.α1、α2均减小 B.α1减小,α2增大
C.α1、α2均增大 D.α1增大,α2减小
6.14C是碳的一种同位素,NA为阿伏加德罗常数,下列说法中不正确的是:( )
①1/8mol14CH4分子中所含中子数为NA ②7g14C原子形成的石墨中所含质子数为3NA
③17g甲基(-14CH3)所含电子数为8NA ④常温常压下,22.4L14CO2其分子数为NA
A.①② B.③④ C.①②③ D.①③
7.11.9g金属锡跟100mL12mol·L-1HNO3共热一段时间。完全反应后测定溶液中c(H+)为
8mol·L-1,溶液体积仍为100mL。放出的气体在标准状况下体积约为8.96L。由此推断氧 化产物可能是( )
A.SnO2·4H2O B.Sn(NO3)4 C.Sn(NO3)2 D.Sn(NO3)2和Sn(NO3)4
8. 等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,且VA=VB+VC,则在C的生成物中,该金属元素的化合价为
A. +4 B. +3 C. +2 D. +1
9.用来表示可逆反应:2A(g)+B(g)![]() 2C(g)(正反应为吸热反应)的正确图像是( )
2C(g)(正反应为吸热反应)的正确图像是( )
 |
10. 用铝箔包住0.2mol金属钠,然后用针扎若干小孔,放入水中,完全反应后,用排水集气法收集到的气体(标准状况下)为
A. H2和O2的混合气体 B.= 2.24L H2
C. >2.24L H2
D.< 2.24L H2
二、选择题(本题共10小题,每小题4分,共40分。每小题有一或两个选项符合题意;若正确答案包括两个选项,只选一个且正确的给2分,但只要选错一个,该小题就为0分)
11.X、Y、Z三种非金属,原子最外层电子数相等,等物质的量的单质X2、Y2、Z2分别与足量钠反应时,反应热为△Hx2>△Hy2>△Hz2,下列判断正确的是 ( )
A.原子半径:X<Y<Z
B.气态氢化物的稳定性:HnX<HnY<HnZ
C.气态氢化物的沸点:HnX>HnY>HnZ
D.最高价氧化物对应的水化物的酸性可能为:HZO4<HYO4<HXO4
12.我国镍氢电池居世界先进水平,国产大功率镍氢动力电池已广泛用于我海军潜艇。常见镍氢电池的某极是储氢合金LaNi5,电池的总反应为:
LaNi5H6 + 6NiO(OH) ![]() LaNi5 +
6Ni(OH)2(LaNi5H6中各元素化合价均为零),下列说法正确的是
( )
LaNi5 +
6Ni(OH)2(LaNi5H6中各元素化合价均为零),下列说法正确的是
( )
A.放电时储氢合金作正极 B.放电时,电子由负极通过外电路流向正极
C.充电时储氢合金作阴极 D.充电时阴极反应:Ni(OH)2 + OH――e-= NiO(OH)+H2O
13.下列各组离子,在指定的条件下能大量共存的是 ( )
A.滴加甲基橙试剂呈红色的溶液:Fe2+、NH4+、Cl- 、NO3-
B.水电离出来的c(OH-)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
C.所含溶质为NaCl的溶液:K+、SiO32-、NO3-、Al3+
D.PH为11的溶液:S2-、SO32-、 S2O32-、Na+
14、下列溶液混和后,溶液一定呈碱性的是: ( )
A、pH=12氢氧化钠溶液与pH=2的某酸等体积混和
B、pH=2某酸与pH=12的某碱溶液等体积混和
C、pH=2的盐酸和pH=12的氨水等体积混和
D、1 mol/L盐酸和1mol/L的Ba(OH)2溶液等体积混合后再稀释100倍
15.碘元素有多种价态,可以形成多种含氧阴离子IxOyn-。由2个IO62-正八面体共用一个面形成的IxOyn-的化学式为 ( )
A.I2O94- B.I2O106- C.I2O118- D.I2O1210-
16.最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS)已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,可以得到的正确结论是 ( )
![]() A.羰基硫属于非极性分子 B.羰基硫的电子式为:
A.羰基硫属于非极性分子 B.羰基硫的电子式为:
C.羰基硫沸点比CO2低 D.羰基硫分子中三个原子处于同一直线上
17.下列各组物质间反应可能包括多步反应 , 其总的离子方程式正确的是 : ( )
A. NaClO (aq) 中通入少量 CO2: C1O- + CO2 + H20 = HClO +HC03-
B. FeCl2在空气中被氧化: 4Fe2++O2+2H20=4Fe3++40H-
C. A1Cl3(aq)中投入过量Na:A13++4Na+2H20 = A102-+ 4Na++ 2H2 ↑
D. FeBr2(aq)中通入少量C12:2Fe2++4Br+3C12= 2Fe3++2Br2+6C1-
18.室温下,在25 mL 0.1 mol/LNaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,
曲线如下图所示,若忽略两溶液混合时的体积变化,有关粒子浓度关系比较错误的是
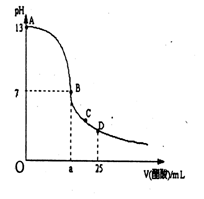 A.在A、B间任一点,溶液中一定都有
A.在A、B间任一点,溶液中一定都有
c(Na+)+ c(H+)= c(CH3COO-)+c(OH-)
B.在B点:a>12.5,且有
c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点:c(Na+)>c(CH3COO-) >c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)= 0.2 mol/L
19.在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.A的转化率变小 B.平衡向正反应方向移动
C.D的体积分数变大 D.a < c+d
20.如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法不正确的是
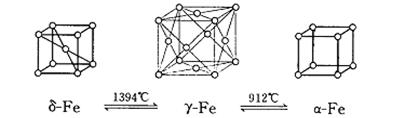
A.δ-Fe晶体中与每个铁原子距离相等且最近的铁原子有8个
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C. 若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
第二部分 非选择题(共80分)
三、(本题包括3小题,共31分)
21.(6分)下列有关实验的叙述,正确的是(填序号) 。
(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)用渗析法分离淀粉中混有的NaCl杂质
(C)无法用分液漏斗将甘油和水的混合液体分离
(D)用酸式滴定管量取20.00mL高锰酸钾溶液
(E)为了测定某溶液的pH,将经水润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓氨水洗涤做过银镜反应的试管
(G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(H) 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(J)在氢氧化铁胶体中加少量硫酸会产生沉淀
(K)用结晶法可以除去硝酸钾中混有的少量氯化钠
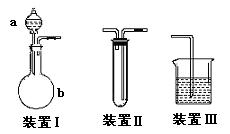 22.(12分)化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能。
22.(12分)化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能。
(1)甲同学认为利用装置Ⅱ可直接收集NH3、H2,但不能收集O2,其理由是:____________ 。
 (2)乙同学认为装置Ⅰ可作为实验室制氧气的快速发生器,对装置Ⅱ稍作改进后即可作为O2的收集装置,乙同学对装置Ⅱ的改进方法是:_________________________,制O2时在装置Ⅰ中的a中加入________________,b仪器中加入__________________。
(2)乙同学认为装置Ⅰ可作为实验室制氧气的快速发生器,对装置Ⅱ稍作改进后即可作为O2的收集装置,乙同学对装置Ⅱ的改进方法是:_________________________,制O2时在装置Ⅰ中的a中加入________________,b仪器中加入__________________。
(3)丙同学认为装置Ⅱ经乙同学改进后只需在装置Ⅱ之后连一尾气吸收装置即可收集SO2气体。试将吸收SO2的尾气吸收装置画在方框内。
(4)丁同学认为利用装置Ⅰ和装置Ⅲ可进行验证Cl2的氧化性比Br2强的实验,进行此项实验时在装置Ⅰ中的a仪器中加入_______________试
剂,b仪器中加入________ 试剂,装置Ⅲ中应加入_______试剂,根据装置Ⅲ中观察到的______________________________________________实验现象即可得出Cl2的氧化性比Br2强的结论。
23、(13分)某校研究性学习小组选择使用下列仪器和药品,验证由铜和适量浓硝酸反应产生的气体中含有NO(实验中使用的N2和O2的用量可自由控制)。已知:
①NO + NO2 + 2OH- = 2NO2- + H2O;②气体液化温度:NO2:21℃、NO:-152℃
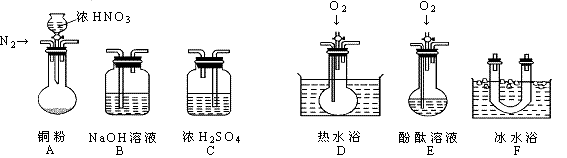
(1)现有甲、乙、丙三位同学分别设计了以下三个实验方案(用仪器的连接顺序表示)。
甲:A→C→F→D→B 乙:A→B→C→E 丙:A→F→D→B
甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓HNO3反应产生的气体中含有NO(填“能”或“不能”)
甲:________; 乙:________; 丙:_________
具体说明不能验证的主要原因(能验证的方案,不必回答原因):
甲方案:_________________________________________________。
乙方案:_________________________________________________。
丙方案:_________________________________________________。
(2)实验开始时首先通入足量的N2,其目的是:__________________________。
(3)确认气体中含NO的现象是:________________________________ 。
(4)如果O2过量,则装置B中发生反应的离子方程式是:____________________________。
四、(本题包括3小题,共31分)
24.(11分)有如下化学反应:2A(g)+B(g)![]() 2C(g),△H<0。
2C(g),△H<0。
(1)若将4molA和2molB在2L的容器中混合,经2s后测得C的浓度为0.6mol·L-1,用物质A表示的平均反应速率为____________;2s时物质B的浓度为_______________;
(2)若把amolA和bmolB充入一密闭容器中,达到平衡时它们的物质的量满足n(A)+n(B)=n(C),则A的转化率为_________________;
(3)若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,混合气体中C的体积分数为_____________;若再通入少量B气体,体系中A的体积分数_____________(填“增大”、“减小”或“不变”),若要使A的体积分数再达到与原平衡状态相同,可采取的措施有____________________________。
25.(10分)有CH4和CO的混合气体0.5mol在足量O2中充分燃烧,完全反应后将生成物用足量碱石灰吸收,碱石灰增重31g,若用足量Na2O2吸收,Na2O2增重15g.
(1)写出燃烧后的产物与Na2O2反应的化学方程式.
(2)原混合气体V(CH4)=________L,V(CO)=_______L(标准状况下),混合气体的平均相对分子质量为:M=_________
26、(10分)已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | I | e |
| 原子核数 | 单核 | 四核 | 双核 |
| 粒子的电荷数 | 一个单位正电荷 | 0 | 一个单位负电荷 |
物质A由a、e构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
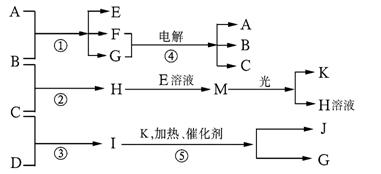
请填写下列空白:
(1)写出下列物质的化学式:B: ;J:_________。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M 。
②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为
。
五、计算题(本题包括2小题,共18分)
|
(1)该盐酸的物质的量浓度为多少?(列式计算)
(2)取40gMnO2与该盐酸在加热条件下反应,欲制得标准状况下的氯气8.96L,取该盐酸的体积至少为 mL。
(3)用所得氯气制取漂白粉,求漂白粉的质量。
28.(9分)生活中,人们越来越注意微量元素的摄入,碘元素对人体健康与发育有着至关重要的作用。若缺少碘元素,则会造成幼儿痴呆、发育不良,易患地方性甲状腺肿。为了预防碘缺乏病,我国卫生部规定每千克食盐中应含有40mg~50mg的碘酸钾。据此回答下列问题:
![]() (1)已知KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定的电流强度和温度下电解KI溶液。总反应化学方程式为
(1)已知KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定的电流强度和温度下电解KI溶液。总反应化学方程式为
KI+3H2O KIO3+3H2↑。阳极反应式为
。
(2)为检验某食盐中是否含有碘酸钾。某同学取食盐样品428g溶解后,加入盐酸酸化的淀粉碘化钾溶液,溶液呈蓝色。反应的离子方程式为
该反应中氧化产物与还原产物的物质的量之比为 。
(3)为进一步验证该样品是否为合格产品,该生再用0.030mol/L的硫代硫酸钠溶液对上述溶液进行滴定,当用去18.00mL时蓝色刚好又褪去(I2+2S2O32-====S4O62-+2I-),计算得每千克该加碘盐中碘酸钾的含量为 ,该加碘食盐为
(填“合格”或“不合格”)食盐。
高三化学质检试题答题卷

1.答题前,考生先将自己的姓名、考试证号填写清楚;
2.在草稿纸、试题卷上答题无效;
![]()
填涂样例:正确填涂■ 错误形式× ○ ● ○ √ ○
填涂说明:请按题号用2B铅笔填涂方框。
| 1 ABCD 8 ABCD 15 ABCD 2 ABCD 9 ABCD 16 ABCD 3 ABCD 10 ABCD 17 ABCD 4 ABCD 11 ABCD 18 ABCD 5 ABCD 12 ABCD 19 ABCD 6 ABCD 13 ABCD 20 ABCD 7 ABCD 14 ABCD |
三、(本题包括3小题,共31分)
21、(6分) (少一个扣一分,多一个倒扣一分,扣完为止)
![]()
![]() 22.(1)
22.(1)
![]() (2)
(2)
 (3)
(3)
![]()
![]()
![]()
![]() (4)
(4)
![]()
![]()
![]() 23.(1)甲: (1分);乙: (1分);丙: (1分)
23.(1)甲: (1分);乙: (1分);丙: (1分)
![]() 甲方案:
甲方案:
![]()
![]()
![]()
![]() 乙方案:
乙方案:
![]()
![]()
![]()
![]()
![]()
![]() 丙方案:
丙方案:
(能验证的方案,不必回答原因,共4分)
![]() (2)
(2分).
(2)
(2分).
![]() (3)
(2分)
(3)
(2分)
![]() (4)
(2分)
(4)
(2分)
四、(本题包括3小题,共31分)
![]()
![]() 24.﹙11分﹚(1)
24.﹙11分﹚(1)
(2)
![]()
![]()
![]()
![]()
![]()
![]() (3)
;
;
;
;
。
(3)
;
;
;
;
。
![]() 25.(10分)(1)
(2分)
25.(10分)(1)
(2分)
![]() (2分)
(2分)
![]()
![]()
![]() (2)
(2分)
(2分)
(2分)
(2)
(2分)
(2分)
(2分)
![]()
![]() 26.(10分) (1) B.
J
(每空1分)
26.(10分) (1) B.
J
(每空1分)
![]() (2) ①
(2分)
(2) ①
(2分)
![]() ②
(3分)
②
(3分)
(3) (3分)
![]() 五、计算题(本题包括2小题,共18分)
五、计算题(本题包括2小题,共18分)
27.(1)
![]() (2)
mL
(2)
mL
(3)
28.(1)
![]()
(2) ;
![]()
![]()
![]()
![]() (3) ;
(3) ;
化学试题答案
| 题目 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | D | A | C | B | B | A | D | C | C |
| 题目 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | BC | D | CD | A | BD | C | CD | AD | D |
![]()

三、(本题包括3小题,共31分)
21、(6分)(BCDGJK) (少一个扣一分,多一个倒扣一分,扣完为止)
22.(1)H2、NH3的密度比空气小,而O2的密度比空气大。
(2)把装置Ⅱ中的进气导管改为长导管插到试管底部,出气导管管口应与胶塞相平
3%的H2O2溶液、少量的MnO2粉末
 (3)
(3)
(4)浓盐酸、KMnO4、NaBr溶液、溶液由无色变橙色
23.(1)甲:能(1分);乙:不能(1分);丙:不能(1分)
乙方案:混合气体在通过B时,因发生反应:NO+NO2+2NaOH![]() 2NaNO2+H2O使NO消耗,后续实验无法验证是否有NO(2分)。
2NaNO2+H2O使NO消耗,后续实验无法验证是否有NO(2分)。
丙方案:混合气体通过F时,NO2与H2O蒸气发生反应:3NO2+H2O![]() 2HNO3+NO 使部分NO2转化为NO,产生干扰,从而不能确认Cu和浓HNO3反应是否有NO生成(2分)。
2HNO3+NO 使部分NO2转化为NO,产生干扰,从而不能确认Cu和浓HNO3反应是否有NO生成(2分)。
(2)排尽整个装置中的空气,防止产生的NO被氧化生成NO2(2分)
(3)D装置中通入O2后有红棕色气体产生(2分)
(4)4NO2+O2+4OH-![]() 4NO3-+2H2O(2分)
4NO3-+2H2O(2分)
四、(本题包括3小题,共31分)
24.﹙11分﹚(1)0.3mol·L-1·S-1 0.7mol·L-1
(2) ![]() ×100% 、
×100% 、
(3)85.7% 减小 升高温度 充入A气体 减小压强
25.(10分)
(1)2CO2 + 2Na2O2 2Na2CO3 + O2 (2分)
2H2O + 2Na2O2 4NaOH + O2↑ (2分)
(2)5.6 L (2分) 5.6 L (2分) 22 (2分)
26.(10分) (1)B.Cl2 J.NO (每空1分)
(2) ①H+ +ClO-= HClO(2分)
②NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH- (3分)
NH4++OH- (3分)
(3)2HCl(g)=H2(g)+Cl2(g);△H= +184.6 kJ·mol-1(3分)
五、计算题(本题包括2小题,共18分)
27.(1)1000×1.18×36.5%/36.5=11.8mol/L
(2)136.5
(3)50.8g
28.(1)I-+3H2O-6e-====IO3-+6H+
(2)5I-+IO3-+6H+====3I2+3H2O 5:1
(3)45mg 合格