专题十三 金属元素及其化合物
Ⅰ[考点分析]
1、了解元素原子核外电子排布的周期性与元素性质递变关系。重点掌握典型金属在周期表中的位置及与其性质的关系。了解其他常见金属单质及其化合物。
2、了解金属钠的物理性质,掌握钠和镁化学性质。从原子的核外电子排布,理解ⅠA 、ⅡA族元素(单质、化合物)的相似性和递变性。以氢氧化钠为例,了解重要的碱的性质和用途。了解钠的重要化合物。
3、其他常见的金属(如:Fe、Al):了解金属的通性,金属冶炼的一般原理。初步了解金属的回收和资源保护。掌握Fe和Al的化学性质。掌握常见金属的活动顺序。以Fe(Ⅱ)Fe( Ⅲ)的相互转化为例,了解变价金属元素的氧化还原性。了解铝的重要化合物。初步了解合金的概念。
Ⅱ、金属单质的知识网络构建:
(1)金属钠及其化合物:金属钠的物性:银白色、硬度小、比水轻、熔点低、易传热、导电
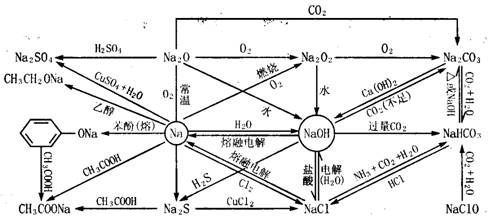
(2)金属镁及其化合物:
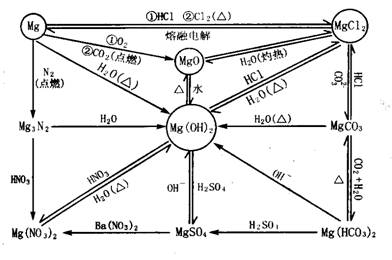
(3)金属铝及其化合物:
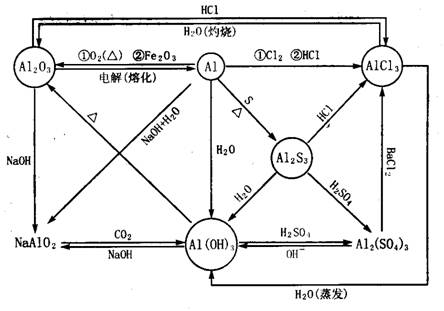
(4)金属铁及其化合物
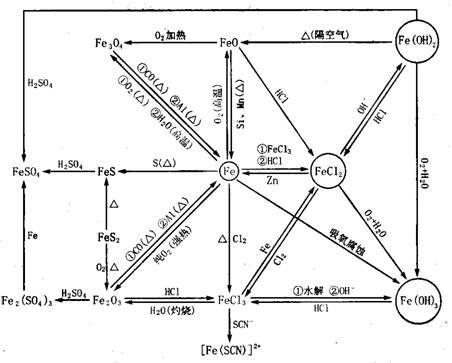
[例题解析]
例1:(2005年上海)含8.0gNaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是 ( )
A.Na2S B.NaHS C.Na2S和NaHS D.NaOH和NaHS
解析:由于不能确定H2S是否过量,因此假设有下列几种情况
若NaOH全生成Na2S时 Na2S的质量为8/40*78*1/2g=7.8g
全生成NaHS时 Na2S的质量为8/40*56g=11.2g而NaOH的质量为8g而得到无水物的质量为7.9g。7.8<7.9<8,7.8<7.9<11.2所以无水物中可能为Na2S和NaOH或Na2S和NaHS,所以无水物中一定有Na2S。
答案:A
点评:本题是一个常规极限法解答题,但仅凭文字计算很容易漏掉一种情况而导致错选,若用图象法和极限法结合解答,则直观明了。数形结合应该是考生处理问题的有效方式。
例题2:某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变成灰绿色,最后变为红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33g。另一份加入含0.001molKMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是____和_____,阴离子是_______.
(2)试通过计算确定该结晶水合物的化学式。
[解析]溶液加Ba(OH)2生成白色沉淀,随即沉淀变为灰绿色,最后变成红褐色,说明水合物中含有Fe2+,逸出能使湿润的红色石蕊试纸变蓝的气体,说明水合物中有NH4+,最后用盐酸处理沉淀,还剩余白色固体说明水合物中有SO42-,再根据计算确定其化学式。
[答案](1)NH4+ Fe2+ SO42-
(2)根据题意![]()
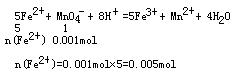
根据离子化合物中阴、阳离子电荷平衡的原理
n(NH4+)+2n(Fe2+)=2n(SO42-)
n(NH4+)=0.01mol
![]() 得n(NH4+): n(Fe2+): n(SO42-):n(H2O)=2:1:2:6
得n(NH4+): n(Fe2+): n(SO42-):n(H2O)=2:1:2:6
该结晶水合物的化学式为(NH4)2Fe(SO4)2·6H2O或[(NH4)2SO4·FeSO4·6H2O]
点评:本题为一道常规题,判断化合物组成,写出化学式,关键是在求
NH4+的物质的量时,用到电荷守恒。
【方法归纳】
1、 方法与技巧:
(1) 铁的化合物与亚铁的化合物间的相互转变
Fe只有还原性,可以被氧化成Fe2+和Fe3+,也可由Fe2+、Fe3+还原而得到Fe;Fe2+既具有氧化性又具有还原性,但主要表现为还原性,当遇到强氧化剂时,被氧化为Fe3+,遇到较强的还原剂时,被还原为Fe2+或者Fe。它们之间能相互转变,其关系常称为铁三角关系。铁的不同价态之间的三角关系,反映出了铁单质及其铁的化合物的化学性质,在解题过程中有重要的作用。
(2)试剂相同、滴加顺序不同,现象不同
A、 NaOH和AlCl3
向AlCl3溶液中滴加NaOH溶液:先出现白色沉淀后消失。
向NaOH溶液中滴加AlCl3溶液:开始无沉淀后出现白色沉淀。
B、 HCl和NaAlO2
向NaAlO2溶液中盐酸:开始出现白色沉淀后消失。
向盐酸溶液中滴加NaAlO2:开始无现象,后出现白色沉淀。
C、 Na2CO3和盐酸(不稳定多元弱酸盐和强酸)
向Na2CO3溶液中滴加盐酸:开始无现象,后产生气泡。
向盐酸溶液中滴加Na2CO3溶液,立即产生气泡。
D、 AgNO3溶液和氨水
向AgNO3溶液中滴加氨水:先出现白色沉淀后消失。
向氨水中滴加AgNO3溶液:开始无沉淀后出现沉淀。
(3)有关Na2O2跟CO2、H2O反应的计算技巧
推广:Wg通式符合(CO)m(H2)n(m=0,1,2,…;n=0,1,2,…)的物质在氧气中燃烧,将其产物通过足量的Na2O2固体,反应完毕后,固体增重Wg,如果(CO)m(H2)n(m=0,1,2,…;n=0,1,2,…)为气体, 反应完毕后,生成气体的体积为原气体体积的一半.符合通式(CO)m(H2)n(m=0,1,2,…;n=0,1,2,…)熟悉的物质有:CO、H2、CH3OH、HCHO、CH3COOH、HCOOCH3、C6H12O6等。
2、命题趋向:从近几年的高考看,碱金属的考查主要侧重于下列三个方面:钠及其化合物的性质推断、碱金属元素性质的比较、有关钠及其化合物的计算。预计今后的考题还会以该元素化合物知识为载体考查有关概念、理论、实验和计算。有关Na2O2的实验,NaHCO3与Na2O2、CO2与NaOH反应的计算将是重点。
有关Mg、Al、Fe的知识的试题在近几年的高考中出现次数很多,它们的离子共存、离子方程式、物质鉴别、制取、推断、计算等题型中大量出现,其中Mg与CO2反应,Mg3N2跟水反应、Mg(OH)2比MgCO3难溶能在推断题中应用,Al及Al2O3、Al(OH)3的两性,Al3+与CO32-双不解;Al3+、Al(OH)3、AlO2-间的转化是考试的热点;铁的变价、Fe(OH)2和Fe(OH3)炼铁的反应多与实验、推断、计算相结合,进行应用。试题形式多样、选择、简答、实验、推断、计算都有。
今后命题的方向主要集中在:铁三角,铝三角,Fe3+、Al3+与AlO2—的双水解,尤其是以Mg、Al、Fe及其化合物为主干的无机推断将仍是重点考查的内容。2006年高考估计上述题型、命题特点基本保持不变。
课堂训练:
1、(2004年广东)下列有关碱金属铷(Rb)的叙述中,正确的是( )
A、灼烧氯化铷,火焰有特殊颜色
B、硝酸铷是离子化合物,易溶于水
C、在钠、钾、铷三种单质中,铷的熔点较高
D、氢氧化铷是弱碱
2、(04广东·)把Ba(OH)2溶液滴入明矾溶液中,使SO42—全部转化成BaSO4沉淀;此时铝元素的主要存在形式是( )
A、Al3+ B、Al(OH)3 C、AlO2— D、Al3+和Al(OH)3
3、(2004·上海·16)将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
A、稀硝酸 B、稀盐酸 C、硝酸铜 D、氢氧化钠
4、(03广东)下列有关纯铁的描述正确的是
(A). 熔点比生铁的低
(B). 与相同浓度的盐酸反应生成氢气的速率比生铁的快
(C). 在潮湿空气中比生铁容易被腐蚀
(D). 在冷的浓硫酸中可钝化
5、(04上海)等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为
(A).3:4:1 (B).3:3:2 (C).6:7:3 (D).6:9:0
6、(18分)某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
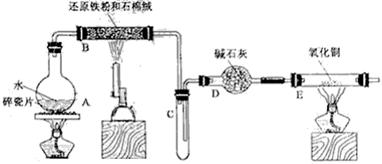
(1)装置B中发生反应的化学方程式是 。
(2)装置E中的现象是 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液→FeCl3溶液→FeCl3·6H2O晶体
① 步骤I中通入Cl2的作用是 。
② 步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
。
③ 该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
。
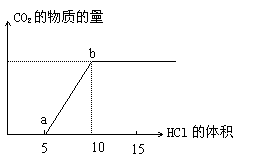 7、下图表示往某Na2CO3溶液中滴入稀盐酸产生CO2的过程。
7、下图表示往某Na2CO3溶液中滴入稀盐酸产生CO2的过程。
(1)写出a点以前发生反应的离子方程式
(2)写出a点到b点发生反应的离子方程式
(3)若某Na2CO3溶液中含m molNa2CO3,滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO3-的物质的量之比为2:1,则滴入稀盐酸的物质的量等于 mol(用m表示)
课堂训练答案:
1、AB 2、C 3、C 4、D 5、A
6、(1)3Fe+4H2O(g)![]()
(2)黑色固体变红,右端管壁有水珠
(3)取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色
(4)① 将Fe2+氧化成Fe3+;② 加热浓缩。冷却结晶,过滤
7、(1)CO32-+H+=HCO3-
(2)HCO3-+H+=H2O+CO2↑
(3)![]()
课后训练:
|
|
|
|
![]()
![]() C.Fe3O4 +
4CO
3Fe + 4CO2 D.2HgO 2Hg + O2↑
C.Fe3O4 +
4CO
3Fe + 4CO2 D.2HgO 2Hg + O2↑
2、(2004年江苏).向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是( )
A.碳酸氢钠溶液中滴加稀盐酸
B.硫酸铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液
D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
3、(2005年广州测试)在一定温度下,向饱和烧碱溶液中放入少量过氧化钠,反应后恢复到原来的温度,下列说法正确的是
A、溶液的pH增大,有O2放出
B、溶液的pH不变,有O2放出
C、溶液中的c(Na+)增大,有O2放出
4、(2005年广州测试)下列对铍及其化合物的叙述,不正确的是
A、氯化铍分子中有2对共用电子对
B、铍原子半径小于硼原子半径
C、单质铍能跟冷水反应放出氢气
D、氢氧化铍能跟氢氧化钠溶液发生反应
D、溶液中的c(Na+)减小,有O2放出
5、(2005年广东模拟)下列各组溶液中 ,仅用物质间相互反应不能一一区别的一组是
A. Fe2(SO4)3、K2CO3、KHSO4、NH4Cl
B. NaOH、Na2CO3、Al2(SO4)3、MgCl2
C. AgNO3、NaCl、KCl、CuCl2
D. BaCl2、Na2SO4、(NH4)2SO4、KOH
6、(2005年丰台检测)电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。有关反应为:2FeCl3+Cu=2FeCl2+CuCl2。
现将一块敷有铜箔的绝缘板浸入8.00×102mL某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00mL,向其中滴入3.00mol/L AgNO3溶液60.00 mL时,溶液中的Cl-恰好完全沉淀。请计算:
(1)溶液A中FeCl3的物质的量浓度为__________;
(2)假若铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于__________;
(3)讨论当剩余固体的组成不同时m与n可能的取值范围,并填入下表
| 剩余固体的组成 | m的取值范围 | n的取值范围 |
| 只有铜 |
|
|
| 有铁且有铜 |
| (用含m的代数式表示) |
(4)当m=100.0,n=96.8时,溶液B中FeCl2的物质的量浓度为_______mol/L。
7、(05年汕头试卷)现有由等质量的NaHCO3和KHCO3组成的混合物a g,与100mL盐酸反应。(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。)
(1)该混合物中NaHCO3与KHCO3的物质的量之比为 。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸中HCI的物质的量为 mol。
(3)如果盐酸过量,生成CO2的体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道 。
(5)若NaHCO3和KHCO3不是以等质量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2
的体积[V(CO2)]范围是 。
8、(2005年,北京) X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:① X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;
② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是。
(2)Z2Y2与X2Y反应的化学方程式是。
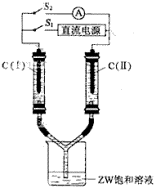
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(I)的电极名称是(填写正极或负极);
C(II)的电极反应式是。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是。
课后训练答案:1、B 2、A 3、B 4、BC 5、C
6、(1)3.00mol/L(1分) (2)67.2g(1分)
(3)(4分)
剩余固体的组成 m的取值范围 n的取值范围
只有铜 0<m≤67.20 0<n≤76.8
有铁且有铜 m>67.2 m-67.2<n≤m+9.6
(4)2.50 mol/L(2分)
7、(1)100 : 84(或25 : 21) (2)![]() (3)
(3)![]()
(4)盐酸的物质的量浓度(其他合理答案也给分)
(5)![]()
8、(1)Na2O (2)2Na2O2+2H2O==4NaOH+O2↑
(3)负极, Cl2+2e-==2Cl- (4)Cu+H2O2+2H+==Cu2++2H2O