高三化学第一学期月考试卷
化 学
原子量:H—1 C—12 O—16 Na—23 S—32 Al—27 Zn—5
一、选择题(每小题只有一个正确答案,每小题2分,共50分)
1.2006年4月22日是第37个“世界地球日”,我国确定的主题是“善待地球一科学发展”。下列行为中不符合这一主题的是 ( )
A.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质
B.大量开采地下水,以满足社会对水的需求
C.减少直至不使用对大气臭氧层起破坏作用的氟氯烃
D.节约能源,提高能源利用率
2.洛阳东都商厦因电焊工违章操作,引发了震惊全国的12.25特大火灾。大火中309人丧生,主要系含高浓度CO2、CO及其他有毒物质的浓烟所致。当火灾发生时,采取的下列措施中不恰当的是 ( )
A.立即撤离火灾现场并拨打119报警
B.若逃生通道被堵,应迅速转移到窗口边或阳台上等待救援
C.若被困在室内,应立即封堵火、烟的进口,并站在室内最高处等待救援
D.若被困在火灾现场,应尽可能贴近地面向火势小、烟雾少的方向撤离
3.下列各组物质,不能由组成它的两种元素单质直接化合得到的是 ( )
A.FeS B.CuS C.Fe3O4 D.Al2S3
4.我国的“神舟五号”载人飞船已发射成功,“嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的![]() ,每百吨
,每百吨![]() 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以![]() 的形式存在。下列说法正确的是 ( )
的形式存在。下列说法正确的是 ( )
A.![]() 原子核内含有4个质子
原子核内含有4个质子
B.![]() 和
和![]() 互为同位素
互为同位素
C.![]() 原子核内含有3个中子
原子核内含有3个中子
D.![]() 的最外层电子数为2,所以
的最外层电子数为2,所以![]() 具有较强的金属性
具有较强的金属性
5.常温常压下能大量共存,并可用浓硫酸干燥的一组气体是 ( )
A.SO2、H2S、Cl2 B.O2、CO2、NO C.O2、H2、SO2 D.NH3、N2、H2
6.向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是 ( )
A.碳酸氢钠溶液中滴加稀盐酸 B.硫酸铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液 D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
7.碳化硼(B4C)陶瓷硬度大,熔点高,具有化学惰性。据此判断,下列不能作为碳化硼陶瓷用途的是 ( )
A.作耐磨材料 B.作润滑材料 C.制切削工具 D.制钠化玻璃
8.下列物质的保存方法正确的是 ( )
A.氢氟酸保存在塑料盖的玻璃瓶中 B.氯水盛放在棕色细口瓶中
C.液臭盛放在用橡皮塞的玻璃瓶中 D.固态碘放在棕色的细口瓶中
9.在pH=1含Ba2+离子的溶液中,还能大量存在的离子是 ( )
A.AlO2— B.ClO— C.Cl— D.SO42—
10.下列叙述正确的是 ( )
A.氯气的性质很活泼,它与氢气混合后立即发生爆炸
B.漂白粉是一种混合物,它的有效成分是氯化钙和次氯酸钙
C.实验室制取氯气时,为了防止环境污染,多余的氯气可用氢氧化钠溶液吸收
D.氯水经光照有气泡逸出后,溶液的pH的值升高
11.下列分离或提纯物质的方法错误的是 ( )
A.用渗析的方法精制氢氧化铁胶体
B.用加热的方法提纯含有少量碳酸氢钠的碳酸钠
C.用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡
D.用盐析的方法分离、提纯蛋白质
12.锂和镁和元素周期表中有特殊“对角线”关系,它们的性质相似。下列有关锂及其化合物叙述正确的是 ( )
A.Li2SO4难溶于水 B.Li与N2反应产物是Li3N
C.LiOH易溶于水 D.LiOH与Li2CO3受热都很难分解
13.以石灰石、食盐、焦炭、水和空气为主要原料,不能生产的化工产品是 ( )
A.漂白粉 B.烧碱 C.硝酸铵 D.玻璃
14.仅用一种试剂鉴别如下物质:苯、CCl4、NaI溶液、NaCl溶液、Na2SO3溶液,下列试剂中不能选用的是 ( )
A.溴水 B.FeCl3溶液 C.酸性KMnO4 D.AgNO3溶液
15.以下有关氧化物的各项叙述中正确的是 ( )
A.酸性氧化物肯定是非金属氧化物
B.非金属氧化物肯定是酸性氧化物
C.不能和酸反应的氧化物,一定都和碱反应
D.碱性氧化物肯定是金属氧化物
16.下列离子方程式书写正确的是 ( )
A.铁跟盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.碳酸氢钙溶液跟过量氢氧化钠溶液反应:Ca2++HCO3—+OH—=CaCO3↓+H2O
C.次氯酸钙溶液中通入过量的CO2:ClO—+H2O+CO2=HCO3—+HClO
D.氯化铝溶液与过量的氨水反应:Al3++4NH3·H2O=AlO2—+4NH4++2H2O
17.某溶液中含有NO3—、SiO32—、AlO2—、S2—等4种离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是 ( )
A.只有S2— B.S2—和NO3—
C.SiO32—、S2—和NO3— D.四种离子都减少
18.将三氧化硫溶解在硫酸中所得到的混合物叫做“发烟硫酸”(H2SO4·nSO3),通常以三氧化硫的质量分数表示其组成。今将0.1185g发烟硫酸试样溶于水,用0.125mol/L的NaOH标准溶液滴定,用去此标准溶液20mL恰好中和,则试样中SO3的质量分数为( )
A.15% B.17% C.34% D.60%
19.将淀粉碘化钾溶液装在羊皮纸袋中,并将表羊皮纸袋下半部浸泡在蒸馏水中,过一段时间后取该蒸馏水进行实验,下列现象能证明羊皮纸袋有破损的是 ( )
A.加入碘水后液体变蓝色 B.加入碘入钾溶液不变蓝色
C.加入硝酸银溶液产生黄色沉淀 D.加入溴水后液体不变蓝色
20.下列描述正确的是 ( )
A.CaH2为离子化合物,在水中能以Ca2+和H-离子形式存在
B.在原电池反应中,负极发生的是还原反应
C.在肥皂水(高级脂肪酸的钠盐溶液)中,若干个阴离子的烃基相互聚集形成胶粒,其直径在1nm—100nm之间,所以肥皂水也能发生丁达尔现象
D.pH=1的醋酸溶液与pH=13的NaOH溶液等体积混合后,所得溶液呈中性
21.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l) Zn(OH)2
(s)+Mn2O3(s)下列说法错误的是 ( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e—=Mn2O3(s+)+2OH—(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
22.下列对Na2O2的叙述中,正确的是 ( )
A.Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
B.Na2O2能与水反应,所以Na2O2可以作气体的干燥剂
C.Na2O2与水反应时,Na2O2是氧化剂,水是还原剂
D.Na2O2与二氧化碳反应时,Na2O2既是氧化剂又是还原剂
23.将氢气、氧气、二氧化碳4: 1: 1的体积比混合,点然爆炸后,再与红热足量的炭充分反应,当恢复到原温度时,混合气体压强是原气体压强的 ( )
A.3/4 B.4/3 C.2/3 D.1/3
24.氢化钠跟水反应时生成氢氧化钠和氢气,现有氢化钠和铝粉的混合物mg,与足量的水充分反应后,若收集到氢气ng,则混合物中铝的质量可能是 ( )
A.大于(m-12n)g B.小于(m-12n)g
C.(m-12n)g D.(m-2n)g
25.将质量分数为40%(密度为1.43g·cm-3)的NaOH溶液与等体积水混合,所得溶液中溶质的质量分数是 ( )
A.=20% B.<20% C.>20% D.≥20%
二、填空题
26.请按要求填空:
(1)用已准确称量的1.06gNa2CO3固体配制0.100mol·L-1Na2CO3溶液100mL,所需要的仪器为: 。
(2)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为: 、蒸发、结晶、 。
(3)除去KCl溶液中的SO42—离子,依次加入的溶液为(填溶质的化学式): 。
27.A、B、C、D是四种可溶的化合物,分别由阳离子K+、Ba2+、Al3+、Fe3+和阴离子OH—、CO32—、NO3—、SO42—两两组合而成,它们的溶液发生如下反应:
A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
A与D反应生成有色沉淀,B与C反应生成白色沉淀和气体。
写出它们的化学式:A: B: C: D:
28.亚硫酸钠中+4价的硫,它既有氧化性又有还原性,现在有试剂:溴水、硫化钠溶液,NaOH溶液、氯化钡溶液、稀硫酸。
(1)要证明亚硫酸钠具有还原性,除亚硫酸钠外还应选用的试剂有 ,看到的现象是 ,反应的离子方程式 。
(2)要证明亚硫酸钠具有氧化性,除亚硫酸钠外还应选用的试剂有 ,看到的现象是 ,反应的离子方程式 。
|
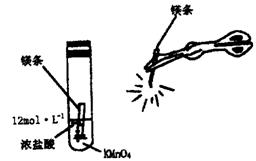
(1)点燃镁条强光照射后可观察最为明显的现象是 。
(2)写出试管内可能发生反应的化学方程式 。
|
|
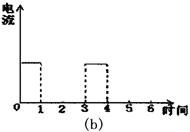
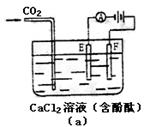
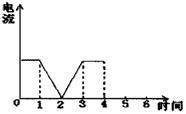
(1)完成实验(a)中电流对时间的变化关系图。
(2)电解时F极发生 反应,电极反应式为 ;E极发生
反应,电极反应式为 ;电解总方程式为
。
(3)电解池中产生的现象:① ② ③ 。
三、计算题。
31.向20mL 0.2mol/L NaOH溶液中缓慢通入一定量CO2气体,将溶液在一定条件下蒸干,若得到白色固体是纯净物,则通入CO2的体积应为 (标准状况)。
写出有关的离子方程式 。
将上述白色固体加水溶液解,加盐酸至pH=7,再蒸干,得到白色固体体的质量应为
。
写出有关计算过程。
|
32.抗击“非典”期间,过氧乙酸CH3C—O—OH是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
![]()
![]()
![]()
![]()
![]()
![]() ① MnO4—+ H2O2+ H+= Mn2++ O2+ H2O
① MnO4—+ H2O2+ H+= Mn2++ O2+ H2O
|
③CH3C—O—OH+2I—+2H+=CH3COOH+I2+H2O
④2Na2S2O3+I2=2NaI+Na2S4O6
![]()
![]()
![]()
![]()
![]()
![]() (1)① Mn4—+ H2O2+ H+= Mn2++ O2+ H2O
(1)① Mn4—+ H2O2+ H+= Mn2++ O2+ H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是 。
(3)取b0mL待测液,用硫酸使溶液酸化,再用浓度为a1mol·L—1的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟KI反应生成I2(反应②和③)。再用浓度为a2mol·L—1的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)
c0= 。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 (填是或否)
高三第一学期月考试卷
高三化学参考答案
一、选择题(每小题只有一个正确答案,每小题2分,共50分)
1.B 2.C 3.B 4.B 5.C 6.A 7.B 8.B 9.C 10.C 11.C 12.B 13.D 14.D 15.D
16.C 17.B 18.A 19.A 20.C 21.C 22.D 23.B 24.A 25.C
二、填空题
26.答(1)100mL容量瓶 烧杯 量筒 玻璃棒 胶头滴管
(2)溶解 过滤 (3)BaCl2[或Ba(OH)2]、K2CO3、HCl
27.答Ba(OH)2 Al2(SO4)3 K2CO3 Fe(NO3)3
28.(1)溴水、溴水褪色、Br2+SO32—+H2O SO42—+2Br—+2H+
(2)硫化钠溶液和稀硫酸、浅黄色沉淀、SO32—+2S2—+6H+
3S↓+3H2O
29.(1)发生爆炸,软木塞被弹出
(2)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O、
Mg+2HCl=MgCl2+H2↑、 H2+Cl2 2HCl
|
30.(1)
(2)氧化、2Cl-2e—、=Cl2;还原、2H++2e—=H2↑
CaCl2+2H2O=Ca(OH)2+Cl2↑+H2↑;
(3)①通CO2时先产生白色沉淀,后又溶解完全;②F极放出黄绿色气体,E极放出无色气体;③E极附近溶液变为红色
31.答44.8mL或≥89.6mL;2OH—+CO2 CO32—+H2O OH—+CO2 HCO3— 0.234g
32.(1)2MnO4+5H2O2+6H+ 2Mn2++5O2+3H2O
(2)淀粉溶液 (3)![]() (4)否
(4)否