高三化学第一学期期末统一考试试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至4页,第Ⅱ卷5至10页。满分150分。考试时间120分钟。
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Mg 24 S 32 Ag107
Cl 35.5 Cu 64 Ca 40
第Ⅰ卷(选择题,共70分)
注意事项:
1、答题前,考生必须将自己的姓名、统考考号、座位号、考试科目用铅笔涂写在答题卡上。
2、第Ⅰ卷共20小题:每小题选出答案后,用铅笔把答题卡上对应的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案。第Ⅱ卷则用黑色钢笔(或圆珠笔)按各题要求答在答题卡相应的位置上。
3、考试结束后,将答题卡交回。
一、选择题(本题包括10小题,每小题3分,共30分,每小题只有一个选项符合题意)
1.下列关于原子的几种描述中,不正确的是
A.18O与19F具有相同的中子数 B.12C与13C具有相同的质量数
C.16O与17O具有相同的电子数 D.15N与14N具有相同的质子数
2.某炼金厂的废水因连降暴雨而溢出,导致河水严重污染。炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸。下列说法不正确的是
A.CN-可以和稀硫酸反应生成HCN B.CN-可被Cl2氧化成(CN)2
C.在水溶液中(CN)2可被F-还原
D.HCN的电子式为 ![]()
3.阿佛加德罗常数约为6.02×1023mol—1,下列叙述正确的是
A.标准状况下,2.24L苯中约含有3.612×1023 个碳原子
B.常温常压下,氧气和臭氧的混和物16g中约含有6.02×1023 个原子
C.25℃时,1L pH=13的氢氧化钠溶液中约含6.02×1023个氢氧根离子
D.0.5molCH4中约含有3.01×1023个电子
4.铊(T1)是某超导材料的组织元素之一,与铝同族,位于第6周期。T13+与Ag在酸性介质中发生反应:Tl3++2Ag=Tl++2Ag+。下列推断正确的是
A.Tl+的最外层有1个电子 B.Tl3+的氧化性比Al3+弱
C.Tl能形成+3价和+1的化合物 D.Tl+的还原性比Ag强
5.下列实验操作中,仪器需插入液面下的有:①制备Fe (OH)2,用胶头滴管将NaOH溶液滴入FeSO4溶液中;②制备氢气,简易装置中长颈漏斗的下端管口;③分馏石油时测量温度所用的温度计;④用乙醇制备乙烯时所用的温度计;⑤用水吸收氨气时的导气管;⑥向试管中的BaCl2溶液滴加稀硫酸。
A.③⑤⑥ B.②⑤ C.①②④ D.①②③④⑤⑥
6.下列说法或表示正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)=C(金刚石);△H=+119kJ/mol,可知金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,若将含1mol
CH3COOH的溶液与含1molNaOH的溶液混合,放出的热量小于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为: 2H2(g)+O2(g)=2H2O(l);△H=-285.8kJ/mol
7.在稀硫酸中加入铜粉,铜粉不溶,再加入下列固体粉末:①FeCl2;②Fe2O3;③Zn;
④KNO3。铜粉可溶解的是
A.①② B. ①④ C.②③ D. ②④
8.目前,科学界拟合成一种“双重结构”的球形分子,即把足球烯C60的分子容纳在Si60分子中,外面的硅原子与里面的碳原子以共价键结合,下列叙述错误的是
A. 该晶体属分子晶体 B. 该分子内原子间都以极性共价键相连接
C. 该物质是一种新化合物 D. 该物质的相对分子质量为2400
9.下列说法一定正确的是
A.位于短周期的x元素的阳离子与Y元素的阴离子具有相同的电子层结构,则两元素的最高化合价X<Y
B.PH=2盐酸和醋酸溶液各10ml,分别加水稀释到1L,所得溶液的PH 较小的是醋酸
C.二氧化硅晶体中,每个硅原子与2个氧原子形成共价键
D.在晶体中只要有阳离子就一定有阴离子
10.纽扣电池的电极反应为:Zn+2OH—=ZnO+H2O+2e-; Ag2O+H2O+2e—=2Ag+2OH— 。下列说法中,正确的是
A.Ag2O发生了氧化反应
B.Zn是正极,Ag2O是负极
C.电池放电时,电解质溶液的pH值基本不变
D.电池放电时,溶液中OH- 向正极移动,H+向负极移动
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,但只要选错一个,该小题就为0分)
11.为了提纯下列物质(括号内为杂质),所选用的除杂试剂与除杂方法都正确的是
| 不纯物 | 除杂试剂 | 除杂方法 | |
| A. | 苯(苯酚) | 溴水 | 分液 |
| B. | C17H35COONa(甘油) | 食盐 | 过滤 |
| C. | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D. | 溴苯(Br2) | 乙烯 | 分液 |
12.经X射线研究证明,PC15在固体状态时,由空间构型分别是正四面体和正八面体的两种离子构成,下列关于 PC15的推断错误的是
A.PC15固体是离子晶体
B.PCl5晶体由[PCl4]+ 和[PCl6]- 构成,且离子数目之比为1:1
C.PC15晶体由[PCl3]2+ 和[PC17]2- 构成,且离子数目之比为1:1
D.PC15晶体具有良好的导电性
13.下列离子方程式书写正确的是
A.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液
Ca2+ + HCO3- + OH-=== CaCO3 ¯ + H2O
B.碳酸钠溶液与醋酸反应
CO32- + 2H+ = CO2↑+ H2O
C.Ca (ClO)2溶液中通入过量的二氧化硫气体
Ca2+ + 2ClO- + H2O + SO2 = CaSO3 ¯ + 2HClO
D.用碳棒作电极电解氯化钾饱和溶液
2Cl- + 2H2O![]() 2OH- + Cl2
+ H2
2OH- + Cl2
+ H2
14.某空气污染监测仪是根据SO2与Br2、H2O的定量反应来测定空气中SO2含量的。上述反应的溴,来自一个装有酸性(H2SO4)KBr溶液的电解槽阳极上的产物,电解槽的阳极室和阴极室是隔开的。当测量某地区空气中SO2含量时,空气(经过除尘)以一定的流速进入电解槽的阳极室,电流计显示每秒通过的电子的物质的量,此时保持溴浓度恒定并恰好与SO2完全反应(空气中不含其它与溴反应的杂质)。那么在此监测过程中发生的主要反应的离子方程式和电解槽中阳极上的电极反应式正确的一组是
①2Br-- 2e- = Br2
②4OH--4e- = O2↑+ 2H2O
③2H++2e- = H2↑
④SO2 + Br2 + 2H2O = 4H++ SO42-+2Br-
⑤2SO2 + O2 + 2H2O=2SO42-+ 4H+
A.⑤① B.⑤② C.④① D.④③
15.某混合气体可能含N2、HCl、CO中的一种或几种,将其依次通过足量NaHCO3溶液和灼热的CuO,气体体积都没有变化;再通过足量Na2O2固体,气体体积减小;最后通过灼热的铜丝,充分反应后气体体积又减小,但还有气体剩余。以下判断中,正确的是
A.一定有N2和HCl,没有CO B.一定有N2,CO和HCl中至少有一种
C.一定有N2、CO和HCl D.一定没有N2,CO和HCl中至少有一种
16.下列各组离子,在指定的条件下能大量共存的是
A.滴加甲基橙试剂呈红色的溶液:Fe2+、NH4+、Cl- 、NO3-
B.PH为14的溶液:S2-、SO32-、 S2O32-、Na+
C.水电离出来的c(OH-)=10-13mol/L的溶液:K+、HCO3-、Br-、Ca2+
D.滴加石蕊试液呈红色的溶液:K+、SO42-、NO3-、NH4+
17.第三周期元素x,它的原子核外最外层实现8电子稳定结构所需的电子数小于次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是
A.x元素最高价氧化物对应的水化物一定是强酸
B.x的单质在固态时一定属于原子晶体
C.x的单质一定是良好的半导体材料
D.x元素在常温下稳定存在的氧化物一定能与烧碱反应
18.在体积、温度都相同的条件下有下列反应:2A(气)+2B(气)![]() C(气)+3D(气)。现分别从两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2mol Ⅱ.C、D的起始物质的量分别为2mol和6mol。以下叙述中正确的是
C(气)+3D(气)。现分别从两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2mol Ⅱ.C、D的起始物质的量分别为2mol和6mol。以下叙述中正确的是
A.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气的百分组成相同
B.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气的百分组成不同
C.达平衡时,Ⅰ途径的反应速率![]() 等于Ⅱ途径的反应速率
等于Ⅱ途径的反应速率![]()
D.达平衡时,Ⅰ途径所得混合气的密度为Ⅱ途径所得混合气密度的1/2
19.“喷水溶液法”是日本科学家最近研制出的一种使沙漠变绿洲的技术,它是先在沙漠中喷洒一定量的聚丙烯酸酯水溶液,水溶液中的高分子与沙土粒子结合,在地表下30-50cm处形成一个厚0.50cm的隔水层,既能阻止地下的盐分上升,又有拦截、蓄积雨水作用,下列对聚丙烯酸酯的说法错误的是
A.它的单体的结构简式为CH2=CHCOOR B.它在一定条件下能发生加成反应
C.它在一定条件下能发生水解反应 D.它具有固定熔沸点
20.将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
A.c (Ac-)>c (Cl-)>c (H+)>c (HAc)
B.c (Ac-)>c (Cl-)>c (HAc)>c(H+)
C.c (Ac-)=c (Cl-)>c (H+)>c (HAc)
D.c (Na+)+c (H+)=c (Ac-)+c (Cl-)+c (OH-)
第Ⅱ卷(非选择题,共80分)
三、(本题包括3小题,共31分)
21.(10分)实验室中根据2SO2+O2![]() 2SO3;ΔH=-196.6 kJ·mol-1设计如图所示实验装置来制备SO3固体。请完成下列问题:
2SO3;ΔH=-196.6 kJ·mol-1设计如图所示实验装置来制备SO3固体。请完成下列问题:
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)____________________。
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是___________________________________________________________________。
(3)小试管C的作用是______________________________________________________。
(4)广口瓶D内盛的试剂是浓硫酸,装置D的三个作用是:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是________________________________。
(6)装置G的作用是________________________________________。
(7)从G装置导出的尾气处理方法是________________________________________。
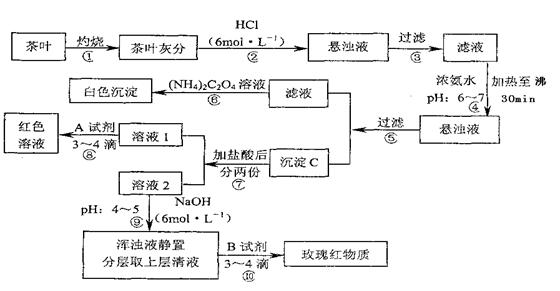
22.(9分)茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、A1、Fe三种元素。
【查阅部分资料:草酸铵[(NH4)2C2O4]属于弱电解质;Ca、A1、Fe完全沉淀的PH:Ca(OH)2:PH≥13;A1(OH)3;PH≥5.5;Fe(OH)3:PH≥4.1】
|
试根据上述过程及信息填空:
(1)步骤④用浓氨水调节pH后,加热至沸30min的作用是 ;
(2)写出检验Ca2+的离子方程式 ;
(3)写出沉淀C所含主要物质的化学式 ;
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式 ;
(5)步骤⑨的作用是 ,猜测步骤⑩的目的是 。
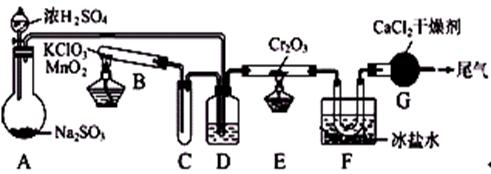
23.(12分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
|
以下是该学习小组部分交流记录及后续探究实验的记录
|
根据上述材料回答下列问题:
(1)A试管上方的长导管的作用是 ;D、E两支试管中CC14的作用是 。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式: 。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。学生1猜想是由于SO2溶解度较大,生成了Ca(HSO4)2的缘故。请你设计实验验证学生1的猜想
。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是 。(写化学式)
(5)学生2将反应后的反应液稀释后进行检验,发现溶液呈酸性,对此,学生2提出的猜想的:铜与浓硫酸反应生成的硫酸铜水解溶液呈酸性。
你的猜想是: 。
请你设计一个简单的实验以验证你的猜想:
四、(本题包括3小题,共30分)
24.(8分)一种火箭推进剂是由液态肼(N2H4)和液态双氧水组成,当它们混合反应时,即产生大量氮气和水蒸汽,并放出大量热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸汽,放出256.65kJ的热量。
(1)写出肼(N2H4)的电子式 ;
(2)反应的热化学方程式为 ;
(3)反应中的氧化剂是 ;
(4)当有1 mol氮气生成时,反应转移的电子数为 NA;
(5)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
25.(10分)亚硝酸钠易溶于水,有咸味,有氧化性,也有还原性。NaNO2大量用于染料工业和有机合成工业中,也可用作水泥施工的抗冻剂。然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
NaNO2 + KI + ![]() NO + I2 + K2SO4
+ Na2SO4 + H2O
NO + I2 + K2SO4
+ Na2SO4 + H2O
(1)完成该化学方程式并配平。
(2)用上述反应来处理NaNO2并不是最佳方法,其原因是_____________________________。从环保角度来讲,要处理NaNO2,所用的物质的_________(填“氧化性”或“还原性”)应该比KI更____(填“强”或“弱”)。
(3)亚硝酸钠可以与酸反应生成亚硝酸,亚硝酸是不稳定的弱酸,它只存在于冷的稀溶液中,易发生如下分解反应:3HNO2=2NO↑+HNO3+H2O
请用两种简便的化学方法来鉴别亚硝酸钠和氯化钠。
方法一:__________________________________________________________。
方法二:__________________________________________________________。
(4) 现有25.00 mL的KI溶液,用酸化的10.00 mL 0.05000 mol/L的KIO3溶液处理(5I- + IO3- +6H+ = 3I2 + 3H2O)。将生成的I2全部除去后,再加入过量的KI溶液,使之与剩余的KIO3反应,然后将溶液调节至中性,析出的单质碘用0.1000 mol/L的Na2S2O3溶液滴定(2S2O32- + I2 = S4O62- + 2I-),用去该溶液的体积为21.15 mL,原KI溶液的物质的量浓度为 。
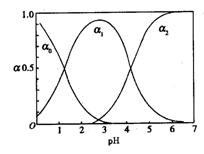 26.(12分)草酸(H2C2O4)是一种有机二元酸,水溶液中草酸的存在形态有三种,各形态的浓度分数α随溶液PH变化的关系如图所示:
26.(12分)草酸(H2C2O4)是一种有机二元酸,水溶液中草酸的存在形态有三种,各形态的浓度分数α随溶液PH变化的关系如图所示:
(1)草酸钠溶液中,![]() 2(填“﹥” “==” 或“﹤”);往该溶液中滴入氯化钙溶液后,
2(填“﹥” “==” 或“﹤”);往该溶液中滴入氯化钙溶液后,![]() 增加,可能的原因是
。
增加,可能的原因是
。
(2)往草酸钠溶液中滴稀盐酸,PH=5时溶液中存在的阴离子有 ,PH=3时,以上两种物质发生的主要反应的离子方程式为 。
(3)菠菜富含草酸,菠菜不能与牛奶、豆腐一起食用的原因是 。
(4)将适量草酸亚铁(FeC2O4·H2O)粉末加入试管中,在酒精灯上边加热边摇动,发生剧烈反应,产生气体克使燃着木条熄灭,生成黑色粉末。反应将结束时,将所得的黑色粉末撒在石棉网上,便会立即自燃起来。
草酸亚铁粉末受热分解的化学方程式为 ,自燃的原因是 。
(5)下表为几种酸对铁锈及锅炉水垢的溶解性比较:
| 酸 | 铁锈[Fe(OH)3]溶解量/g | 水垢(CaCO3)溶解量/g |
| 盐酸 | 0.7911 | 全溶 |
| 磷酸 | 0.1586 | 微溶 |
| 草酸 | 0.7399 | 0.0036 |
| 醋酸 | 0.1788 | 0.1655 |
下列说法正确的有 。
A.同物质的量浓度时,酸性越强的酸除铁锈效果越好
B.草酸除水垢效果差的原因是因为草酸酸性太弱
C.铁锈或水垢在酸中的溶解性与酸根离子的性质可能有关
D.硫酸除铁锈和水垢的效果都好
五、(本题包括1小题,共9分)
27.(9分)由乙烯合成有机物F(二乙酸乙二酯),采用下列合成路线:
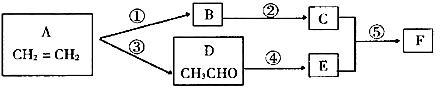
|
![]() (1)已知有机物COOCH3的名称为乙二酸二甲酯。请写出F的结构简式
(1)已知有机物COOCH3的名称为乙二酸二甲酯。请写出F的结构简式
COOCH3
(2)在上述反应中属于取代反应的有 (填反应代号)。
(3)A、D、E、F中能引入C中官能团的物质有 (填反应物代号),其反应⑤的化学方程式分别为
六、选做题(本题包括2小题,每小题10分,考生只能选做一题。28小题为“有机化学基础”内容的试题,29小题为“物质结构与性质”内容的试题)
28.(10分)
已知①两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应:
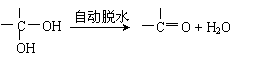 |
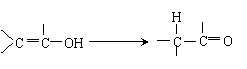 ② 羟基与烯碳原子相连时,它的结构也是不稳定的,易发生下列转化:
② 羟基与烯碳原子相连时,它的结构也是不稳定的,易发生下列转化:
现有分子式为C9H8O2Br2的物质M,可在一定条件下发生下述一系列反应 :
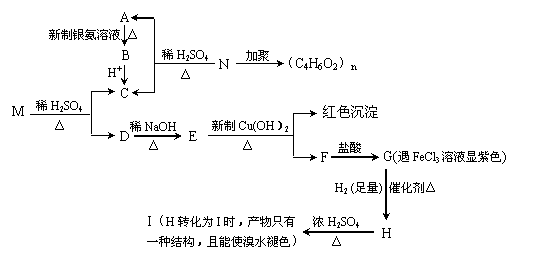
请回答下列问题:
⑴G→H、H→I的反应类型分别是 。
⑵M的结构简式为 ;N的结构简式为 。
⑶写出下列反应的化学方程式:
①A→ B的化学方程式 ;
②H→I的化学方程式 ;
29.(10分)下表列出了前20号元素中的某些元素性质的有关数据:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
试回答下列问题:
(1) 以上10种元素的原子中,失去核外第一个电子所需能量最少的是 __(填写编号)。
 (2)
上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)___________________________。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于__________________
;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式____________________________________。
(2)
上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)___________________________。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于__________________
;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式____________________________________。
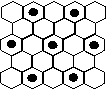
(3) 元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
高三化学参考答案及评分标准
一、选择题(本题包括10小题,每小题3分,共30分,每小题只有一个选项符合题意)
1. B 2.C 3.B 4.C 5.C 6.C 7.D 8.B 9. B 10.C
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意)
11.BC 12.C D 13.AD 14.C 15.B 16.B D 17.D 18.AD 19.BD 20.BD
三、(本题包括3小题,共31分)
21.(10分)(1)检查装置的气密性(2)水与浓硫酸作用放热,有利于SO2的放出 (3)缓冲、防止倒吸 (4)①干燥SO2和O2 ②使SO2和O2混合均匀 ③通过观察控制气体比例和气流速度
(5)温度过高不利于SO3的生成,且影响催化剂的活性(2分)
(6)防止外界水蒸气进入与SO3反应 (7)用NaOH溶液吸收(其余每空1分)
22.(9分)(1)使Al3+、Fe3+完全沉淀(1分)
(2)Ca2++(NH4)2C2O4 CaC2O4↓+2NH4+(2分)
(3)Fe(OH)3、Al(OH)3(各1分,共2分)
(4)Fe3++3SCN—
Fe(SCN)3(写成其它正确的络合离子形式给分,2分)
(5)使Fe3+转化为Fe(OH)3沉淀;检验Al3+(或铝元素)存在。(各1分,共2分)
23.(12分)(1)冷凝回流(1分)。防止倒吸(1分)。
△
|
(3)取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成。(或者加热、加盐酸检验SO2气体等方法,开放题,正确即可)(2分)
(4)CuO、CuS、Cu2S(或CuO、CuS可CuO、Cu2S)(2分)
(5)铜与浓硫酸反应的实验中硫酸过量使溶液呈酸性(2分)。取稀释后的溶液适量于试管中,加入足量的铁粉,若有无色无味的气体产生,证明硫酸过量(开放题,正确即可)(2分)
四、(本题包括3小题,共30分)
24.(8分)
(1) ![]() (2分)
(2分)
(2)N2H4 (l)+2H2O2 (l)=N2 (g)+4H2O (g);△H=-641.63 kJ/mol (2分)
(3) 双氧水 (1分)
(4) 4 (1分)
(5)产物稳定且不会污染环境 (2分)
25.(10分)
(1)2,2,2,H 2SO4 2,1,1,1,2 (2分)
(2)是反应生成了NO ,该物质会造成大气污染(1分),还原性,强 (每空0.5分)
(3)方法一:取适量样品于两支试管中,分别加入稀盐酸,有气体产生,气体在瓶口变为红棕色的为NaNO2,无明显现象的为NaCl(2分)
方法二:取适量样品于两支试管中,分别加入稀盐酸和碘化钾淀粉溶液,若溶液变蓝,证明该物质的是NaNO2;若无明显现象,该物质则是NaCl(其它合理答案也可)(2分)
(4)0.02950 mol/L (2分)
26.(12分)(1)﹥(1分) C2O42-与Ca2+形成沉淀(1分)
(2)C2O42-、HC2O4-、OH-、Cl-(2分)
C2O42- + H+ = HC2O4- (1分)
(3)生成草酸钙沉淀,使钙流失(1分)
![]() (4)FeC2O4·H2O
(4)FeC2O4·H2O ![]()
![]() Fe + 2CO2↑+ H2O↑(2分)
Fe + 2CO2↑+ H2O↑(2分)
温度高,且铁的颗粒很小,与空气接触面大,反应速率快(2分)
(5)C(2分)
五、(本题包括1小题,共9分)
27.(9分)(1)CH3COOCH2(2分)
CH3COOCH2
(2)②和⑤(2分)
|
![]() 2CH3COOH+CH2OH
CH3COOCH2+2H2O
2CH3COOH+CH2OH
CH3COOCH2+2H2O
CH2OH CH3COOCH2 (2分 )
六、选做题(本题包括2小题,每小题10分,考生只能选做一题。28小题为“有机化学基础”内容的试题,29小题为“物质结构与性质”内容的试题)
28.(10分)(1)加成反应 消去反应 (2分)
![]()
|
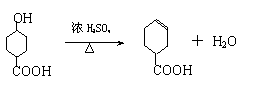
![]() (3) ①CH3CHO+2Ag(NH3)2OH 2Ag↓+CH3COONH4+3NH3+H2O
(3) ①CH3CHO+2Ag(NH3)2OH 2Ag↓+CH3COONH4+3NH3+H2O
②
(4分)
29.(10分)(1)②
(2) PCl3、CCl4
第三周期ⅥA族 ![]()
⑶ KC8
(每空2分)