高三化学第一学期期末考试试题
高三化学试题
说明:本试卷分第I卷(选择题)和第II卷(非选择题),时间为120分钟,满分100分。
可能涉及的相对原子质量:H—1,O—16,C—12,N—14,Na—23,Mg—24,Al—27,P—31,S—32,Cl—35.5,Fe—56,Cu—64,Zn—65,Ag—108,Ba—137
一、选择题(本题共5小题,每题只有一个正确选项,每小题2分,共10分)
1、下列实验能获得成功的是: ( C )
A、苯和浓溴水用铁作催化剂制溴苯
B、向氯化钠溶液中滴加浓硫酸制HCl气体
C、淀粉与质量分数为20%的硫酸共煮制单糖
D、电石与水反应在启普发生器中进行制乙炔
2、随着机动车的拥有量逐年升高,机动车尾气的污染也越来越受到人们的关注,因机动车尾气的排放可能造成光化学烟雾的气体是: ( A )
A、NO2 B、SO2 C、CO2 D、CO
3、用NA表示阿伏加德罗常数,下列叙述中正确的是: ( B )
A、12g 的金刚石晶体中含有碳碳键的数目为4NA
B、46g N2O4 含有的原子数一定为3NA
C、500mL 1.0mol/L 的CH3COOH 溶液中含有的H+ 数为0.5NA
D、1mol FeCl3 制成胶体,所得胶体的粒子数为NA
4、已知ICN的性质和卤素相似。氰化碘分解反应的方程式为:2ICN=I2+(CN)2,下列关于ICN的叙述正确的是: ( B )
A、ICN的晶体是离子晶体 B、ICN是共价化合物
C、ICN不能与NaOH溶液反应 D、ICN在常温下可能是气体
5、下列各组离子在溶液中能够大量共存的是: ( D )
A、Na+、AlO2-、K+、HCO3- B、Fe2+、NH4+、SO42-、S2-
C、Fe3+、SCN-、Na+、CO32- D、Ca2+、HCO3-、Cl-、K+
二、选择题(本题共15小题,每题只有一个正确选项,每小题3分,共45分)
6、两种硫酸溶液,一种物质的量浓度为C1 mol/L,密度为ρ1 g/cm3,另一种物质的量浓度为C2 mol/L,密度为ρ2 g/cm3,当它们等体积混合后,溶液的密度为ρ3 g/cm3,则混合溶液的物质的量浓度为: ( D )
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
7、已知氯化溴(BrCl)能发生如下反应:①BrCl + H2O === HCl + HBrO ②nBrCl + 2M === MCln + MBrn,下列推断不正确的是: ( A )
A、BrCl与水反应,它既是氧化剂又是还原剂
B、BrCl同Br2 和Cl2 具有相似的化学性质
C、反应①和反应②分别是非氧化还原反应和氧化还原反应
D、BrCl的氧化性强于Br2 而弱于Cl2
8、在一容积恒定的容器中充入2molA和1molB反应:2A(g) + B(g) ![]() xC(g),达到平衡后,C的体积分数为W%,若维持容器的容积和温度不变,按起始物质的量:A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%。则x的值为:
(
C )
xC(g),达到平衡后,C的体积分数为W%,若维持容器的容积和温度不变,按起始物质的量:A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%。则x的值为:
(
C )
A、2 B、3 C、可能是2,也可能是3 D、无法确定
9、下列离子方程式错误的是: ( B )
A、向20mL沸水中加入2mL饱和FeCl3 :Fe3+ + 3H2O === Fe(OH)3 (胶体) + 3H+
B、用氨水吸收少量SO2 :NH3·H2O + SO2 === NH4+ + HSO3-
C、碳酸氢镁溶液中加入过量石灰水:
Mg2+ + 2HCO3- + 2Ca2+ + 4OH- === 2CaCO3↓ + 2H2O + Mg(OH)2↓
D、向FeCl3 溶液中加入过量的Na2S溶液: 2Fe3+ + 3S2- === 2FeS↓ + S↓
10、下列各组离子在指定的环境中能大量共存的是: ( C )
A、HP = 1的溶液中:Na+、S2-、K+ 、MnO4-
B、PH = 7的溶液中:Al3+ 、Cl-、SO42-、 HCO3-
C、PH>11 的溶液中:Na+ 、AlO2-、 K+、 CO32-
D、有Fe3+存在的溶液中: Cu2+、 NH4+、 SiO32-、 I-
11、X、Y两个绝热容器中均盛有25mL 2mol/L的NaOH溶液,向X中通入560mL (标况下)CO2 ,向Y中加入1.1g 干冰,完全反应后的两容器中,下列说法不正确的是: ( D )
A、两容器中C(Na+)相等
B、两容器中均有:C(Na+) = 2C(CO32-) + 2C(HCO3- ) + 2C(H2CO3)
C、两容器中各种离子浓度均有:C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+)
D、X中溶液PH等于Y中溶液PH
12、下列物质能使品红溶液褪色的是: ( D )
①活性炭 ②过氧化钠 ③次氯酸钠 ④SO2 ⑤干燥的氯气
A、除①外都可以 B、除⑤外都可以 C、只有②③④可以 D、全部都可以
13、下列处理问题的方法正确的是: ( A )
①金属钠着火,可以用泡沫灭火器扑灭 ②皮肤上沾上浓H2SO4,应马上用布擦去,并立即用大量水冲洗 ③汞滴在桌面上应迅速用抹布擦净 ④CO2气体中混有CO,可用点燃的方法除去CO ⑤NaCl溶液中混有AlCl3溶液,可加入适量氨水除去 ⑥苯、四氯化碳、亚硫酸钠溶液、氯化镁溶液可以用溴水鉴别。
A、②⑥ B、①③④⑤ C、②④⑤⑥ D、②③⑥
14、A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a + b),则A、B两种元素形成的化合物的化学式可能表示为: ( B )
A、B3A2 B、BA2 C、A3B2 D、AB2
15、10.8g氮的氧化物NxOy和50g灼热的铁在密闭真空容器中反应一段时间后,生成0.1mol Fe3O4和0.1mol N2。则NxOy是: ( C )
A、NO B、N2O3 C、NO2 D、N2O5
16、误食白磷可用CuSO4 溶液解毒,已知0.275mol的白磷与含1.5mol CuSO4 的溶液刚好完全反应生成0.6mol H3PO4,还有H2SO4 和CuxPy生成,则CuxPy中的P的化合价是: ( C )
A、+5 B、+3 C、-3 D、-6
17、在蒸馏水中加入等物质的量的AgNO3 和NaCl,再用石墨电极电解该溶液,并收集两极的电解物,则阳极产物与阴极产物的质量之比最接近: ( A )
A、8∶1 B、35.5∶108 C、71∶108 D、不能确定
18、下列过程与对应的图形相符合的是: ( D )
A、往AlCl3溶液中滴加NaOH溶液 B、往H2S溶液中通入SO2
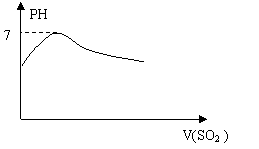 |
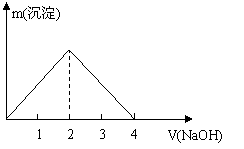
C、往氨水中加入CH3COOH溶液 D、Zn与盐酸反应是一个放热反应,往100mL 5mol/L的盐酸溶液中加入Zn片
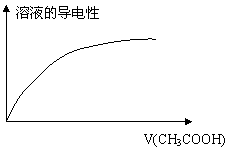 | |||
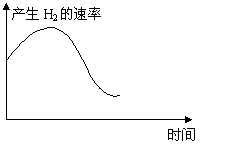 | |||
19、已知:⑴ Al(OH)3的电离方程式为:
H+ + AlO2- + H2O ![]() Al(OH)3
Al(OH)3
![]() 3OH- +
Al3+
3OH- +
Al3+
⑵无水AlCl3晶体的沸点为182.9℃,溶于水的电离方程式为:
AlCl3 === Al3+ + 3Cl-
下列关于Al(OH)3和AlCl3说法正确的是: ( D )
A、均为强电解质 B、均为弱电解质
C、均为离子化合物 D、均为共价化合物
20、已知某温度下,0.1mol/L的NaHB强电解质溶液中C(H+ ) > C(OH- ),则下列关系式一定正确的是: ( C )
A、C(Na+ ) = C(HB- ) + 2C(B2- ) + C(OH- ) B、溶液的PH = 1
C、C(Na+ ) = 0.1mol/L ≥C(B2- ) D、C(H+ )·C(OH- ) = 10-14
第II卷
一、二选择题答题卷:(5×2=10;15×3 = 45;共计55分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
三、填空题(共33分)
21、(3分)下列实验中所选仪器或操作不合理的是 。
A、用托盘天平称量11.5g 氯化钠晶体。
B、用碱式滴定管量取25.00mL溴水。
C、用瓷坩埚灼烧各种钠的化合物。
D、测溶液的PH时,用洁净、干燥的玻璃棒醮取溶液,滴在用蒸馏水润湿的PH试纸上,再与标准比色卡比较。
22、(5分)已知某溶液中只存在OH-、H+、CH3COO-、Na+、,推测其离子浓度大小顺序有如下四种关系:
① C(Na+)>C(CH3COO-)>C(OH-)>C(H+)
② C(Na+)>C(CH3COO-)>C(H+)>C(OH-)
③ C(CH3COO-)>C(Na+)>C(H+)>C(OH-)
④ C(Na+)>C(OH-)>C(CH3COO-)>C(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为 (填编号)。
(2)若上述关系中③是正确的,则溶液中的溶质为 。
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为C(NaOH) C(CH3COOH)(选填 >、<或 =,下同),混合前酸中的C(H+)和碱中的C(OH-)的关系是:
C(H+) C(OH-)
23、(10分)“化学多米诺实验”即利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只控制第一个反应,就好像多米诺骨牌游戏一样,下图就是一个“化学多米诺实验”在实验过程中的装置图。
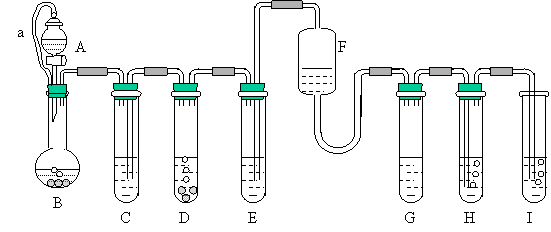
各装置中试剂或物质是:(A) 2mol/LH2SO4 (B) Zn (C) 2mol/H2SO4+CuSO4 (D) Zn (E) CuSO4溶液 (F) NH3·H2O (G)30%H2O2 (H) 饱和H2S溶液 (I) NaOH溶液。
已知:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O该反应产物可作为H2O2分解的催化剂。
请回答下列问题:
(1)进行实验前必须进行的操作是 。
(2)反应过程中B与D两容器中反应速率比较B D(填<、>、=),原因
是 。
(3)H中的现象是 。
(4)I中可能发生的反应的化学方程式 。
(5)A和B之间导管a的作用是 。
(6)在该实验中不涉及的反应类型是(填序号) 。①分解反应 ②化合反应 ③置换反应 ④复分解反应。
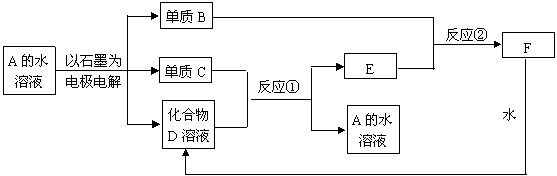 24、(7分)下图中A~F均为中学化学中常见物质。它们之间的转化关系如下:
24、(7分)下图中A~F均为中学化学中常见物质。它们之间的转化关系如下:
(1)若反应①和②不需要特定的反应条件就能进行,则单质B是 ,化合物D是 ,电解一段时间后,原溶液的PH (填“增大”“减小”或“不变”)
(2)若反应①和②需要在一定的条件下才能进行,则电解A溶液的化学反应方程为: 。C与D的稀溶液不反应,但若通入B气体或用D的浓溶液,在加热条件下可以反应生成A溶液,写出这一反应的化学方程式:
。
25、(8分)常温下,有PH=12的NaOH溶液100mL,若将其PH变为11,(设溶液的体积可直接相加,计算结果保留小数点后一位)
(1)若用PH=10的Ba(OH)2溶液,应加入 mL。
(2)若用PH=2的盐酸,应加入 mL。
(3)若用0.01mol/L的CH3COOH溶液V1mL,则V1的取值为 。
(填取值范围)
(4)若用PH=2的任意一元酸HR的溶液V2mL,则V2的取值为 。
(填取值范围)
26、(12)已知常温时反应2Fe3+ + Cu === 2Fe2+ + Cu2+在水溶液中能够发生,将22.4g 由铜和三氧化二铁组成的混合物粉末加入到浓度为1mol/L的硫酸中发生相应的反应。
(1)若固体恰好完全溶解,消耗硫酸的体积为V,求V的取值范围。(6分)
(2)若硫酸溶液过量,反应后溶液的体积为1L,测得此溶液中的浓度为,求原混合物中含铜多少克?(7分)
高三期末考试化学参考答案
一、二选择题答题卷:(5×2=10;15×3 = 45;共计55分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | A | B | B | D | D | A | C | B | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | D | A | B | C | C | A | D | D | C |
三、填空题(共33分)
21、(3分)B、C、D
22、(5分)(1)CH3COONa;①。 ——各1分
(2)CH3COOH、CH3COONa —— 1分
(3)<、< ——各1分
23、(10分)
(1) 检验装置气密性(1分)
(2) < (1分)
C中CuSO4、H2SO4被压入D,与Zn反应形成Cu-Zn原电池(2分)
(3) 有乳白色(或浅黄色)沉淀产生 (1分)
(4) 2H2S + 2NaOH === Na2S + 2H2O (2分)
(5) 平衡A、B内压强,使A中液体易于流入B中(2分)
(6) ② (1分)
|
|
2Cu + 2H2SO4 ==== 2CuSO4 + 2H2O (2分)
25、(8分)
(1) 1000 (2分); (2) 81.8 (2分);
(3) V1<81.8 (2分); (4) V2≤81.8 (2分)。
26、(12分)
(1) 0.3L≤V<0.42L (6分)
(2)若Cu过量时,Cu的质量为14.4g; (3分)
若Fe2(SO4)3 过量时,Cu的质量为3.2g 。 (3分)