高三化学教学质量检测评估(A卷)
理科综合能力测试(化学部分)
本试卷可能用到的相对原子质量:C—12 H—1 O—16
一选择题(每小题只有一个选项符合题意,每题6分,共48分)
6短周期元素X、Y的原子序数相差2,下列叙述正确的是
A .X与Y不可能位于同一周期
B. X与Y不可能形成原子个数比为1:1型离子化合物
C.X离子与Y离子电子层结构可以相同,也可以不同
D.X与Y形成的共价化合物中,各原子最外层一定满足8电子的稳定结构
7下列离子方程式正确的是
A.向Ca(ClO)2溶液中通入SO2气体:Ca2++2ClO-+H2O +SO2 =CaSO3↓+2HClO
B.电解饱和MgCl2溶液:2H2O +2Cl-![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.酸性FeSO4溶液中加入双氧水:2Fe2++H2O2 +2H+=2Fe3++2H2O
D.向饱和碳酸氢钙溶液中加入足量氢氧化钠溶液:
Ca2++HCO3-+OH-=CaCO3↓+H2O
8.在强酸性无色透明的溶液中,能大量共存的离子组是
A.NH4+、Al3+ NO3- SO42- B K+ Na+ AlO2- NO3-
C K+ NH4+ MnO4- SO42- D Na+ K+ NO3- HSO3-
9.设NA为阿伏加德罗常数,下列说法不正确的是
A非标准状况下.22.4L氦气中不可能有NA个氦原子
B 18g水中含有的电子数为10NA
C 1molCl2与金属Na完全反应,可以得到2NA个电子
D 某气体含有NA个分子,则该气体所占的体积称为气体摩尔体积
10用标准电极电解NaCl和CuSO4的250ml混合溶液,经过一段时间后,两极分别得到11.2L(标准状况下)的气体。则原溶液中NaCl的物质的量浓度不可能是
A 0.5mol/L B 1mol/L C 1.5mol/L D 4mol/L
11达菲(Tamiflu)被认为是目前世界上公的能够治疗人禽流感病的唯一有效药物,它是由我国特有中药材八角的提取药——莽草酸(shikimicacid)为原料合成的。已知莽草酸和达菲的结构式如下:
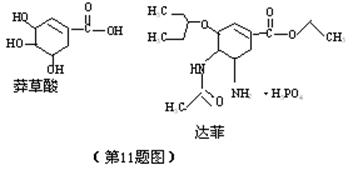
下列判断正确的是
A它们互为同系物
B 1mol莽草酸最多和4molNaOH反应
C两者都能使溴的四氯化碳溶液褪色
D两者在一定条件即能与NaOH溶液反应又能与盐酸反应
12 2006年1月12日美国升空的探测器在7月4日与“彗星相撞,产生4.5吨TNT当量爆炸威力。其火箭推进剂仍然以肼(N2H4)作为主要燃料,NO2为氧化剂,反应生成N2和水蒸气。已知N2(g)+2O2(g)= 2NO2(g);ΔH= +67.7KJ/mol,
N2H4(g)+O2(g)=N2(g)+2H2O (g);ΔH= —534KJ/mol。下列关于肼和NO2反映的热化学方程式中,正确的是
A. 2 N2H4(g)+2 NO2(g)=3 N2(g)+4H2O (l); ΔH= —1135.7KJ/mol
B. 2 N2H4(g)+2 NO2(g)=3 N2(g)+4H2O (g); ΔH= —1000.3KJ/mol
C. N2H4(g)+ NO2(g)=![]() N2(g)+2H2O (l); ΔH= —1135.7KJ/mol
N2(g)+2H2O (l); ΔH= —1135.7KJ/mol
D. 2 N2H4(g)+2 NO2(g)=3 N2(g)+4H2O (g); ΔH= —1135.7KJ/mol
13、下列除去括号内杂质的有关实验操作方法中错误的是
A.FeCl2溶液(FeCl3):加足量的铁粉,充分反应后过滤
B.苯(苯酚):加足量的溴水振荡,静置后过滤
C.乙酸乙酯(乙酸):加足量的饱和Na2CO3溶液振荡,然后分液
D .CO2(SO2):通过装有足量的酸性KMnO4溶液的洗气瓶,然后干燥
二非选择题
26、(17分)二氯化硫(SCl2)熔点—780C,沸点590C,密度1.638g/cm3,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2),以下是由氯气与硫反应合成二氯化硫的实验装置,其中F中装有无水CaCl2固体。
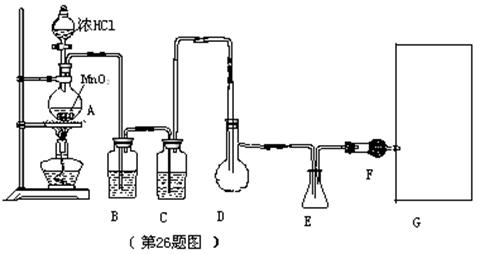
试回答下列问题:
(1)装置A中发生反应的化学方程式为:
(2)装置C中盛放的试剂是 ,其作用为
(3)实验开始前先排尽系统中空气,在D中放入一定量的硫粉,加热使之融化,然后摇动烧瓶使硫附着在烧瓶内壁形成一薄层膜,这样做的目的是
(4)实验时,如何防止E中液体挥发?
(5)画出虚线框内与F连接的仪器,并指出其中盛装试剂名称,以完善该实验装置。
27、(16分)A—N均为中学化学中常见的物质(或其溶液),其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。
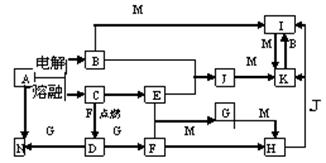
(第27题图)
请填空:
(1)H的化学式为 ,D的电子式为 ,G的结构式为
(2)B和N反应的离子方程式为
(3)G与M反应的化学方程式为
(4)I可用于净化水,原因是
28、(14分)通常羟基与烯键碳原子相连时,会发生下列转化。
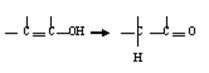
已知有机物A是由C、H、O三种元素组成,原子个数比为2:3:1,其蒸气密度为相同状况下H2密度的43倍,E能与NaOH溶液反应,F转化为G时,产物只有一种结构,且G能使溴水褪色。现有下图所示的转化关系。
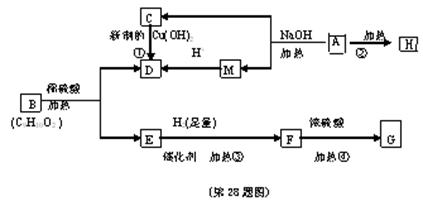
回答下列问题:
(1)指出④反应的类型
(2)写出A、B的结构简式:A B
(3)写出下列化学方程式
反应②
反应④
29、(13分)在一定温度下,向一容积不变的容器中加入3molSO2和2molO2及固体催化剂使之反应:2SO2(g)+O2(g)![]() 2SO3(g);ΔH= —196.6KJ/mol,已知达到平衡后气体压强为开始时的90%,此时:
2SO3(g);ΔH= —196.6KJ/mol,已知达到平衡后气体压强为开始时的90%,此时:
(1)反应达平衡时放出的热量为
(2)保持同一温度,在相同的容器中,将起始物质的量该为amolSO2、bmolO2、cmolSO3(g)(a,b,c都不为零),欲使平衡时各组分的体积分数仍与上述平衡相同。
①a、b、c必须满足的关系是(一个用a,c表示,另一个用b,c表示)
, .
②达到平衡时,(1)和(2)放出的热量 (填序号)
A相等 B前者小 C前者大于或等于后者 D前者大
③欲使起始时反应向正反应方向进行,a的取值范围是
理科综合能力测试(化学部分)答案及评分标准
一选择题(每小题只有一个选项符合题意,每题6分,共48分)
6 C 7 C 8 A 9 A 10 D 11 C 12 D 13 B
二非选择题
26、(17分)
(1)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O.....................(4分)
MnCl2+Cl2↑+2H2O.....................(4分)
(2)浓硫酸 干燥Cl2 ...............................(各2分)
(3)防止加热硫粉时,空气中的氧气与硫粉反应;增大接触面积以加快反应速率。........................................(4分)
(4)将锥形瓶放入冰水中冷却 ...........................(2分)
(5) (加有安全瓶等不扣分)............(3分)
(加有安全瓶等不扣分)............(3分)
27、(16分)(方程式每式4分,其余每空2分)
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() (1)Fe3O4 Na+[ O O ]2-Na+ H—O (直线型也给分)
(1)Fe3O4 Na+[ O O ]2-Na+ H—O (直线型也给分)
H
![]() (2)Cl2
+ 2OH- Cl-
+ ClO- +H2O
(2)Cl2
+ 2OH- Cl-
+ ClO- +H2O
![]()
(3) 4H2O (g)+3Fe Fe3O4 + 4H2
(4)FeCl3水解生成的氢氧化铁胶体具有较大的表面积,能吸附水中悬浮杂质,形成沉淀,且Fe(OH)3胶粒带正电荷,能使水中泥沙等发生聚沉。(水解、吸附)
28、(14分)
![]() (1)消去反应....................................... (2分)
(1)消去反应....................................... (2分)
|
|
![]()
![]()
![]()
![]()
![]()
![]()
|
OOCCH3
![]()
![]()
|
|
29、(13分)
(1)98.3KJ .......................................(2分)
(2)①a+c=3 2b+c=4 ..........................(各3分)
②D...........................................(2分)
③ 2 < a < 3 ..................................(3分)