专题十五 无机框图推断题
【考点分析】
无机框图推断题是以元素化合物知识为主,集基本概念、基本理论为一体的综合性题目。具有考查知识面广、题型多变、思考容量大等特点。这类题既能考查学生掌握元素与化合物的知识量及掌握熟练程度,又能考查学生的逻辑思维能力,这类试题特点是综合性强、物质间关系复杂,导致学生解题时常常难以入手。
【典型例析】
例1、(上海)聚合硫酸铁(PPS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原成Fe2+。实验步骤如下:
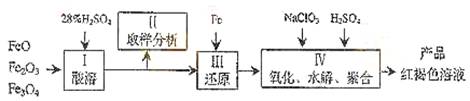
⑴用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有__________。
(a)容量瓶 (b) 烧杯 (c)烧瓶
⑵步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是_____________________。
(a)控制溶液中Fe2+与Fe3+含量比 (b)确定下一步还原所需铁的量
(c)确定氧化Fe2+所需NaClO3的量 (d)确保铁的氧化物酸溶完全
⑶用NaClO3氧化时反应方程式如下:
6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用硝酸氧化,则反应方程式如下:
6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + 2NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊。利是________________________________,弊是___________________________。
聚合硫酸铁溶液中SO42—与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42—与Fe3+物质的量之比。
⑷测定时所需的试剂______________。
(a)NaOH (b)FeSO4 (c)BaCl2 (d)NaClO3
⑸需要测定__________和_________的质量(填写化合物的化学式)。
⑹选出测定过程中所需的基本操作_____________(按操作先后顺序列出)。
(a)萃取、分液 (b)过滤、洗涤 (c)蒸发、结晶
(d)冷却、称量 (e)烘干或灼烧
解析:本题综合考查铁及其化合物的性质,一定质量分数溶液的配制及化学实验基本操作等内容。(1)根据配制一定质量分数溶液的配制步骤,可知所需玻璃仪器除量筒外,还需要烧杯。(2)铁的氧化物溶于H2SO4时可得含Fe2+、Fe3+的溶液,而为抑制Fe3+水解,原料中Fe3+必须还原为Fe2+,为确定下一步铁的用量必须测定Fe3+含量,而再用NaClO3将Fe2+氧化为Fe3+时,NaClO3的用量取决于Fe2+的总量,故选b、c。(3)由所给反应知氧化6 mol FeSO4需HNO3 2 mol价格为O.32元,NaClO3 1 mol价格为O.45元,故用HNO3代替NaClO3的利在于原料成本降低,弊则是产生的NO会污染环境。(4)~(6)要测定SO42—与Fe3+的物质的量之比,需分别测定一定量的溶液中SO42—的物质的量和Fe3+的物质的量即可,故所选用试剂为BaCl2和NaOH,通过过滤、洗涤、烘干灼烧,冷却称量可得m(BaSO4)、
m(Fe2O3),进而计算得出答案。
答案:(1)b
(2)b、c
(3)利:氧化相同量Fe2+,所用原料成本较低 弊:产生的气体NO对大气有污染
(4)a、c
(5) Fe2O3、BaSO4
(6)b、e、d
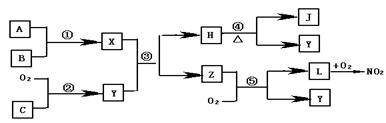
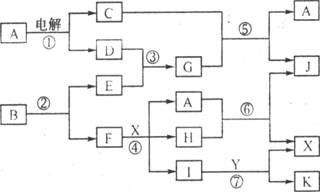
例2、(江苏)下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。
请按要求填空:
(1) 写出下列物质的化学式:A:_______,E_______,F_______,Y_______。
(2)反应⑤的化学方程式为:________________________________________。
(3)1mol B通过反应②得到1mol F,B中F的质量分数为72%,则B的化学式为:__________。
解析:由G是极易溶于水的碱性气体,Y是胃酸的主要成分,可推断G、Y分别是NH3、HCl,并进一步可确定反应③是工业上合成氨的反应,D、E分别是H2和N2中的一种。又因A是一种无色液体,A电解时分解生成C和D,C又能与NH3发生反应⑤,两种产物中有一种是A,则可判断出A为H2O、C为O2、D 为 H2、E为N2。由于反应⑤为氨的催化氧化反应,又是工业上制X的主要反应之一,可推出X为硝酸。由K是不溶于稀硝酸的白色沉淀,再结合反应④、⑥、⑦不难判断F为Ag。根据1mol B分解得到1mol Ag和一定量的N2,可设Ag的化学式为AgNX,则108/(108+14x)=72%,解得x=3,所以B为叠氮化物AgN3。
答案:(1)H2O N2 Ag HCl
(2) ![]()
(3)AgN3
例3、(广东)如下图所示,已知①甲、乙、丙、丁均为前三周期元素的单质。
②在一定条件下甲与丙和甲与丁都按物质的量之比1:3反应,分别生成X和Y,在产物中元素甲呈负价。③在一定条件下乙与丙和乙与丁都按物质的量之比1:2反应,分别生成Z和W,在产物中元素乙呈负价。
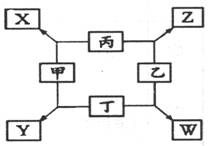
请填空:
(1)甲是_______,乙是______。(填化学式)
(2)甲与丙反应生成X的化学方程式是________________________。
(3)乙与丁反应生成W的化学方程式是________________________。
解析:由甲与丙、甲与丁都按物质的量之比1:3反应,可设甲、丙(丁)是单原子分子或双原子分子,进而得出它们之间形成的化合物的化学式为B6A、B3A、B3A2[A、B分别为甲、
丙(丁)的组成元素],由于A为负价,显然B6A不可能。根据后两个化学式可得:A为-3价,初步判断A为氮元素,即甲为氮气。联系B3A、B3A2的化学式及较熟悉的合成氨等反应,可知X和Y分别为NH3、Mg3N2。结合乙与丙、丁的反应特征,再推出乙为氧气,可知Z和W分别为H20和MgO。
点燃 点燃
答案:(1)N2 02 (2)N2+3Mg = Mg3N2 (3)2H2+02 = 2H20
点燃
或(2)N2+3H2![]() 2NH3
(3)O2+2Mg = 2MgO
2NH3
(3)O2+2Mg = 2MgO
【方法归纳】
一、框图题的求解方法
1、求解步骤
框图题由于题目字数少,题意及所供信息新且简洁,因此审题就显得尤为重要。其解题过程往往分为三步:
(1)读审 — 仔细读题,审清题意。读题包括阅读求解要求。求解要求,往往亦能给考生以重要的启示,这点不能忽视。“读审”是解题的基础。
(2)找析 — 找准“题眼”,即找准解题的突破口然后联系新信息及所学旧知识,应用正向逆向思维、发散收敛思维、横向纵向思维等多种思维方式,进行综合分析、推理。“找析”是解题的关键。
(3)解答 — 看清要求,认真解答。“解答”是解题的落脚点。
2、解题要领
(1)思维的整体性。这一类命题,往往环节较多,环节(框图)与环节之间联系紧密,相互制约,命题整体性极强。处理时,必须认真研究命题的整体要求,仔细推敲每一个环节,结合所给条件,弄清楚该环节的反应及实验原理,与前一环节的联系,对后面环节的影响,各个环节都推敲完成后,将全过程串联起来审查,确认整个过程合理且符合命题要求了,才能动手解答,否则回答可能不完整。
(2)假设推理的合理性。由于命题环节多,且命题时有意设置了一些障碍,如隐去反应条件,空出一些环节等。解题时,必须找到其中的关键环节,再进行假设推理,能正确将全过程按命题要求理顺,才可以动手解答。
二、框图题寻找“题眼”的途径
1、从物质的组成、结构方面寻找
例如,具有正四面体结构的物质可能为甲烷或白磷或NH4+;不含金属元素的离子化合物为铵盐;组成为A2B2型的物质可能为Na202、H202、C2H2等。
2、从实验现象寻找
例如,气体燃烧呈苍白色火焰的必为H2在Cl2中燃烧;在空气中点燃后火焰呈蓝色,则气体可能为CO、H2、CH4、H2S等。
3、从反应类型寻找
例如,同一元素的气态氢化物和气态氧化物反应生成该元素的单质和水,则该元素可能为S或N;两种溶液混合生成沉淀和气体,则反应可能为Ba(OH)2与(NH4)2S04,或可溶性铝盐与可溶性金属硫化物(如Na2S、NaHS)、可溶性碳酸盐(如Na2CO3、NaHCO3) 或可溶性铁盐与可溶性碳酸盐(如Na2CO3、NaHCO3)之间的双水解反应;遇水能生成气体和难溶性物质的可能为Al2S3、 Al(CH3)3或Mg3N2。
4、从典型性质寻找
如具有臭鸡蛋气味的气体必为H2S;与H2S反应有淡黄色沉淀生成的气体可能为02、C12或SO2;使湿润红色石蕊试纸变蓝的气体为NH3;密度最小的气体为H2;地壳中含量最多的元素为O,最多的金属元素为Al;能溶解SiO2的酸为HF;遇苯酚生成紫色溶液的离子为Fe3+等。
5、从反应条件寻找
如必须控制在170℃的反应,必是制取乙烯的反应;稀溶液与铜常温下不反应,浓溶液与铜加热时反应为浓硫酸。
6、从数据去寻找
根据计算或题给信息,可获取某些数据,这些数据也可使我们找到突破口。如物质的熔点较低,说明可能为分子晶体;反之,熔点较高则可能为原子晶体或离子晶体。
7、从转化关系寻找
X Y Y H2O
如盐A有如下转化:A → B → C → D → E,D比C式量大16,E为酸。则可推知:若X为碱,则A中含NH4+;若X为酸,则A中含S2-(或HS-)。
【专题训练】
1、下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体其余均为气体。根据图中关系推断:
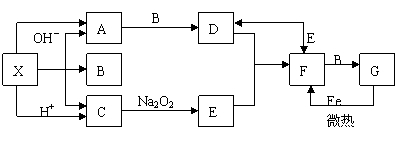 |
(1)化学式X A B
(2)写出C→E的化学反应方程式
(3)实验室收集气体D和F的方法依次是 法和 法。
答案:1、(1)NH4HCO3 NH3 H2O
(2)2CO2+2Na2O2=2Na2CO3+O2 (3)排水 向上排空气
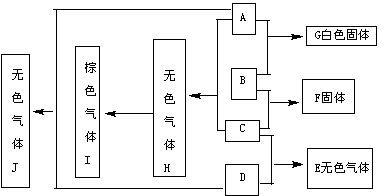 2、下图中每一个方框内的字母代表一种物质,常温常压下,A、B、C、D、均为单质,且B为金属,其它三个为双原子分子的气体,它们在一定条件下,发生图中所示的化合反应,得到化合物E、F、G、H、I和J,这些化合物在常温常压下的状态及颜色已在图中注明,
有关反应的化学计量数为:
2、下图中每一个方框内的字母代表一种物质,常温常压下,A、B、C、D、均为单质,且B为金属,其它三个为双原子分子的气体,它们在一定条件下,发生图中所示的化合反应,得到化合物E、F、G、H、I和J,这些化合物在常温常压下的状态及颜色已在图中注明,
有关反应的化学计量数为:
(1)A与B按物质的量之比n(A)∶n(B)=1∶2完全反应生成G
(2)B与C按物质的量之比n(B)∶n(C)=3∶1完全反应生成F
(3)C与D按物质的量之比n(C)∶n(D)=1∶3完全反应生成E
请填空:
(1)物质B是 ,物质D是
(2)B与C反应生成F的化学方程式为:
(3)A与H反应生成I的化学方程式为: 。
答案:(1)Mg(镁),H2(氢)
(2)3Mg+N2![]() Mg3N2 (3)O2+2NO=2NO2
Mg3N2 (3)O2+2NO=2NO2
3、有 A、B、C、D四种单质,在一定条件下,A、B、C分别跟 D发生化合反应相应生成甲、
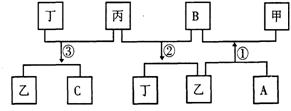 乙、丙(甲、乙、丙每个分子中都含有
乙、丙(甲、乙、丙每个分子中都含有
10个电子)而B跟C发生化合反应生成
丁,这些单质和化合物之间发生如下反
应关系:
(1)写出下列物质的化学式
甲______________乙___________丙_____________丁_____________
(2)写出反应①②③的化学方程式
①____________________________________
②_________________________________________
③_________________________________________________________。
答案:(1) HF、H2O、NH3、NO
(2) 2F2 + 2 H2O ==4HF+ O2 4NH3+ 5O2==4NO +6H2O 4NH3+ NO==5N2 +6H2O
4、 A、B、C、是单质,X、Y、Z、H、J、L是化合物,组成B的元素是绿色植物生活所必需的微量元素之一,且B在空气中燃烧可以得到X和J,X和J均为固体,X水
解可生成两种碱性物质。在适当条件下,它们相互之间有下图所所示的转化关系:
|
(1)用化学式表示化合物L 单质C 。
(2)物质Z的分子空间构型是 。
(3)反应①的化学方程式 ________________ 。
(4)反应⑤的化学方程式 。
(5)在常温下用气体密度测定NO2的相对分子质量,实验值比理论纸值偏 (填“高”或“低”),其原因是 。
答案:(1)NO H2 (2)三角锥型 (3)3Mg+N2 Mg3N2
![]() (4)4NH3+5O2
(4)4NH3+5O2 4NO+6H2O (5)高 NO2分子相互反应有N2O4生成(2NO2 N2O4)
5、(北京)如下图所示,已知①单质E可作半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应。
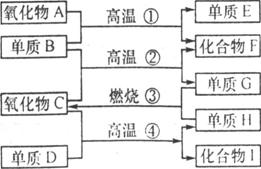
据此回答:
(1) 化合物F是_________;
(2) 化合物I是_________;
(3) 反应④的化学方程式是____________________________。
答案:(1)CO (2)HF (3)2F2+2H20=4HF+O2
6、(2004·崇文)A~L所代表的各物质是中学化学里常见的物质,已知B、J是单质,A是化合物;E的溶液跟苯酚溶液混合,溶液呈紫色。A~L各物质之间相互反应转化的关系如下图所示(未注明必要的反应条件):
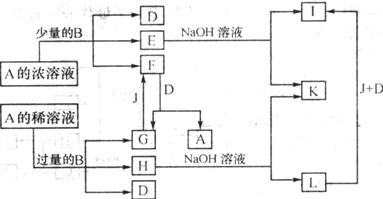
请回答:
(1)B在A的浓溶液中反应而溶解的条件是___________,而常温下B在A的浓溶液中难以反应而溶解的原因是________________________。
(2)写出下列化学方程式:
F→G+A___________________;
G→F_____________________;
E→I的离子方程式_____________________。
(3)L转化成I的现象是___________________。
答案:(1)加热 钝化
(2)3NO2+H20=2HN03+NO; 2NO+O2=2NO2; Fe3++30H-=Fe(OH)3↓;
(3)白色沉淀先变成灰绿色,最后变成红褐色
7、(北京)X、Y、Z为三个不同短周期非金属元素的单质,在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是_______;
②生成固体C的化学方程式是_________________。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是_______;
②向苛性钠溶液中通入过量的A,所发生反应的离子反程式是______________________;
③将Y与(1)中某单质的水溶液充分反应可生两种强酸,该反应方程式是_____________。
答案: (1)①H2 ②NH3+HCl=NH4Cl
(2)①SO2 ②H2S+OH-=HS-+H20 ③S+3C12+4H20=H2SO4+6HCl
8、(深圳)A、B、C三种常见单质的有关反应如下图所示。已知B、E、D、F的水溶液显酸性,E在一定条件下有还原性,但不能被浓H2SO4氧化。
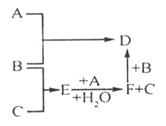
试推导判断:
(1)B是金属单质,还是非金属单质?______________________。
(2)写出C、D的化学式:C_________、D__________。
(3)写出由F→D的离子方程式___________________________________。
答案:(1)非金属单质 (2)H2 FeCl3 (3)2Fe2+ + Cl2 =2 Fe3+ +2Cl-