第四章 非金属及其化合物
第一讲 无机非金属材料主角—硅
。教学重点:SiO2的性质
教学难点:SiO2的结构、硅酸盐的组成
知识梳理
在地壳里,硅的含量在所有元素中居第次于氧全部以_____ 态存在。硅元素位于元素周期表中的第___周期,族:__其原子结构示意图:_____。
一、二氧化硅及硅酸
1、二氧化硅
(1)物理性质:二氧化硅广泛存在于自然界中,沙子、石英的主要成分就是二氧化硅,SiO2不溶于水,熔点___、硬度___。水晶、石英是二氧化硅晶体。
(2)结构:二氧化硅晶体是由硅原子和氧原子构成的,晶体中硅原子和氧原于的个数比为___,Si02晶体的平面结构图:

(3)二氧化硅出化学性质
①酸性氧化物的性质:Si02是酸性氧化物,是 ___ 的酸酑,___于水。常温下Si02与NaOH溶液反应得到硅酸钠(Na2SiO3),反应的化学方程式为:_________。
高温下Si02能和碱性氧化物(如CaO)反应生成硅酸盐,反应的化学方程式为:_________。
②常温下,SiO2能与氢氟酸(HF)反应,此反应常用于刻蚀玻璃,反应的化学方程式为:_________。
③二氧化硅的弱氧化性:Si02高温下与C作用可制取粗硅,反应的化学方程式为:_________。
(4)二氧化硅的用途 :①Si02是制造光导纤维的主要原料。②Si02常被用来制造石英表中的压电材料(3)Si02用于制造各种玻璃制品。
思考:(1)实验室为什么不用带玻璃塞的试剂瓶盛放NaOH溶液?应用什么样的塞子?(2)Si02不溶于水,如何由Si02制取H2SiO3?
2、硅酸
(1)硅酸(H2Si03)硅酸不溶于水,其酸性比碳酸的酸性___。
(2)硅酸钠(Na2Si03): Na2SiO3的水溶液俗称水玻璃,常用作黏合剂。往Na2SiO3溶液中通人CO2,能制得硅酸,反应的化学方程式:_________。
二、硅酸盐
1、硅酸盐制品性质稳定、熔点较高,大都难溶于水,
(1)硅酸盐的组成比较复杂,常用氧化物的形式表示。表示顺序为:活泼金属氧化物、较活泼金属氧化物、二氧化硅、水。例如:硅酸钠(Na2Si03)改写为氧化物形式为:________;钠长石: (NaAlSi308)改写为氧化物形式为________。
(2)玻璃①生产原料:________。②生产设备:________。
③生产过程:把原料粉碎并按适当比例混合后,放人玻璃熔炉中加热、熔化,冷却后得到普通玻璃。主要的化学反应有:______________。
④主要成分:普通玻璃是Na2Si03、CaSi03和SiO2在一起的混合物。
⑤重要性质:玻璃在常温下呈固态,没有固定的熔点,受热在一定温度范围内逐渐软化。
⑥玻璃的种类:铅玻璃(用于制光学仪器);有色玻璃[蓝色钴玻璃(Co202)、红色玻璃(Cu2O);钢化玻璃(用于汽车车窗):
(3)水泥:水泥是重要的建筑材料,其主要成分是______________,水泥具有____性。
(4)陶瓷:陶瓷材料是人类应用最早的硅酸盐材料,①高温结构陶瓷,如氮化硅(Si3N4)陶瓷,碳化硅(SiC)陶瓷等。②生物陶瓷:如氧化铝陶瓷(A1203),氧化锆陶瓷(Zr02) 等; ③压电陶瓷:以钛酸钡(BaTi03)和钛酸铅(PbTi03)为主要成分。
三、硅单质
1、硅的物理性质
单质硅有晶体硅和无定形硅两种。晶体硅是___色、有___光泽、脆而硬的固体,是良好的___材料。
2.硅的化学性质
(1)常温下硅的化学性质稳定,但能和氟(HF)、强碱(NaOH)发生反应。
①硅和氟气反应生成四氟化硅气体,化学方程式为:_____________。
②硅和氢氟酸反应生成四氟化硅,放出学方程式为:_____________。
③硅与NaOH溶液作用生成硅酸钠,反应的化学方程式为:____________。
(2)在加热条件下,硅能和某些非金属单质发生反应。
①硅与氧气在加热时反应生成二氧化硅程式为:_____________。
②硅和C12在加热条件下反应生成四氯的化学方程式为:_____________。3.硅的制取:自然界中没有游离态的硅,常见的化合态的硅有__和__等。工业上,
用焦炭在电炉中还原二氧化硅得到含有少量杂质的粗硅。反应的化学方程式:_____
___________。在该反应中,氧化荆是____,还原剂____。
4.硅主要的用途:硅可以用来制造____、____、____、____等。
四、小结:比较SiO2、CO2在物理化学性质上异同。
| 二氧化碳 | 二氧化硅 | |
| 状态 | ||
| 溶解性 | ||
| 与NaOH反应 | ||
| 与酸反应(HF) | ||
| CO2通入水玻璃 | ||
| SiO2与Na2CO3 高温下反应 | ||
疑难点拨
一、 硅及其化合物的有哪些特性?
1.Si的还原性大于C,但C却能在高温下还原出Si:SiO2+2C=Si+2CO↑
2.非金属与碱反应一般无氢气放出,但Si可以:Si+2NaOH+H2O=Na2SiO3+2H2↑
3.非金属单质一般不与无氧酸反应 ,但Si可以与HF作用:Si+4HF=SiF4+2H2↑
4.非金属单质一般为非导体,但Si可以作为半导体。
5.SiO2是硅酸的酸酐,但不溶于水,不能直接与水作用生成硅酸。
6.非金属的氧化物的熔点一般较低,但二氧化硅的熔点很高,原因是它为原子晶体。
7.酸性氧化物一般不与酸反应,但SiO2可以与HF酸作用: SiO2+4HF=SiF4↑+2H2O
8.硅酸不溶于水。
二、为什么玻璃没有固定的熔点?
有规则空间排列的晶体是有固定熔点的。玻璃是一种玻璃态物质,玻璃态是介于结晶态与无定形之间的一种物质状态。它的结构特点是:它的粒子不象晶体那样有严格的空间排列,但又不象无定形那样无规则排列。人们把玻璃态的这种结构特征称为“短程有序而远程无序”。即从小范围来看,它有一定的晶体排列,但从整体上看,却像无定形物质那样无晶形的排列规律。所以,玻璃态物质没有固定的熔点,而是在一定的温度范围内逐渐软化而变化为液态。
三、玻璃瓶塞会跟NaOH等碱性溶液反应,为什么NaOH溶液还能用玻璃瓶盛装?
由于玻璃不是简单的Na2SiO3 、CaSiO3 、 SiO2机械混合物,它们相互结合为多聚硅酸的长链,金属阳离子处于无规则的多聚硅酸的长链包围之中。所以玻璃中的Na2SiO3 、CaSiO3 、 SiO2不是独立存在的,即玻璃中SiO2与一般所说的是有区别的。瓶口内侧与瓶塞都是经过磨砂处理的,表面粗糙,造成碱性的液体容易滞留,并且水分蒸发,碱液浓度增大,促使二者更易反应。其他部位因表面光滑而难于反应。由于从组成和结构上看多聚硅酸的长链与SiO2相似,所以通常把玻璃跟NaOH等碱性溶液反应简单地看成SiO2与碱溶液的反应。
四、二氧化硅与碳酸钠和碳酸钙反应的原因?
玻璃工业生产的主要原理是在强热的条件下发生:
Na2CO3 + SiO2 = Na2SiO3 + CO2 ↑,CaCO3 + SiO2 = CaSiO3 + CO2 ↑
上述反应都是在高温条件下进行的,有利于二氧化碳从体系中挥发出来,而二氧化硅不行,所以反应可以进行。符合难挥发性的酸酐制取易挥发性的酸酐的道理。所以上述反应不与“Na2SiO3 + CO2+H2O= Na2CO3+ H2SiO3↓”矛盾,因为后者是在溶液中进行的,符合复分解反应的原理。
五、怎样用氧化物来表示硅酸盐?
氧化物的顺序:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水,氧化物前系数的确定:除氧元素外,其他的元素按配置前后原子个数守恒原则配置系数。注意事项:氧化物之间用“·”隔开;系数配置出现分数应化为整数。如:正长石KAlSi3O8要写成K2O·Al2O3·6SiO2形式。
六、碳族元素化合价有哪些特点?
碳族元素主要化合价为+2和+4,非金属元素还有-4价。其中Pb+2价稳定;其余的+4价稳定。
典例剖析
【例1】向下列物质的浓溶液中缓慢地通入过量CO2气体,整个过程中无明显现象的是
A.水玻璃 B.苯酚钠 C.漂白粉 D.饱和碳酸钠 E.氯化钙
解析: CO2溶于水生成碳酸,碳酸的酸性比盐酸弱,而比硅酸、次氯酸、苯酚强。根据酸与盐反应的规律(弱酸不能制强酸),过量CO2通入硅酸钠溶液中有白色沉淀H2SiO3生成,CO2通入苯酚钠溶液中会生成苯酚浊液;CO2通入次氯酸钙溶液过程中会生成碳酸钙白色沉淀,CO2过量最终沉淀会消失;过量CO2通入饱和碳酸钠溶液会生成碳酸氢钠,碳酸氢钠溶解度比碳酸钠溶解度小而结晶析出;CO2通入氯化钙溶液无明显现象。 答案:E。
规律总结: 此题易出错的地方有三个:①CO2通入氯化钙溶液无明显现象;②题干中CO2是过量的;③碳酸氢钠因溶解度小而结晶析出。
【例2】(2002年上海)将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的
物质的量(n)和通入CO2体积(y)的关系正确的是
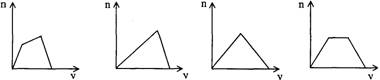
A B C D
解析:CO2通入KOH和Ca(OH)2的混合溶液中,首先发生反应CO2+2OH-+Ca2+=CaCO3↓+H2O,此段时间内随着CO2的不断通入,沉淀量逐渐增加;等Ca(OH)2反应完,溶液中还剩余OH-,再通CO2,即发生反应:CO2+2KOH=K2CO3+H2O,此段时间内,随着CO2的不断通入,沉淀量保持不变; 等KOH反应完,继续通CO2,即发生反应:CaCO3+CO2+H2O=Ca(HCO3)2,沉淀量逐渐减少,一直到沉淀完全溶解。D图象符合题意。实际上这里还有一个定量关系:完全生成碳酸钙沉淀所需的CO2的体积和使碳酸钙沉淀完全溶解所需的CO2的体积相等。答案:D。
规律总结:遇到通入气体沉淀又溶解的这类题,首先联想到碳酸盐,亚硫酸盐转化为酸式盐,当全部转化为正盐时,如有OH-,则应把OH-中和完毕,酸式盐再转化为正盐。
【例3】Fe3O4若看作“混合氧化物”时可写成FeO·Fe2O3,若看作一种盐时又可写成Fe(FeO2)2.根据化合价规则和这种书写方法,Pb3O4可以分别写成________和________。
解析: Fe元素有+2、+3价,Fe3O4中有1/3Fe元素为+2价,2/3Fe元素为+3价.与Fe元素不同,铅是+2价、+4价.按化合价规则及题中要求的写法(即低价在前,高价在后,且高价元素形成酸根),故Pb3O4应改写为下列两种形式2PbO·PbO2和Pb2PbO4。
【例4】 草酸晶体与浓硫酸共热可制得CO,其化学方程式如下:H2C2O4 ![]() CO↑+CO2↑+H2O,现利用该反应制取CO气体,要求:a.验证CO还原性及其氧化产物。b.剩余气体CO不能排入大气中,并回答有关问题:
CO↑+CO2↑+H2O,现利用该反应制取CO气体,要求:a.验证CO还原性及其氧化产物。b.剩余气体CO不能排入大气中,并回答有关问题:
(1)试从图中选用几种装置(有些可重复使用)连接成一套实验装置,所选用的装置及连接顺序为 。
(2)用简洁的文字说明所选的装置,如何达到上述两要求:a. ;b. 。
(3)在装置C中的化学反应方程式为 。
(4)本实验有四个酒精灯A、B、C、H,正确操作时点燃酒精灯的顺序是 ;试简单说明理由; 。熄灭酒精灯的顺序是 ;试简单说明理由: 。
(5)用有效气体还原0.40g![]() 将生成的气体通入过量澄清石灰水中,生成0.75g白色沉淀,则
将生成的气体通入过量澄清石灰水中,生成0.75g白色沉淀,则![]() 中
中![]() 值是
,
值是
,![]() 值是
。
值是
。
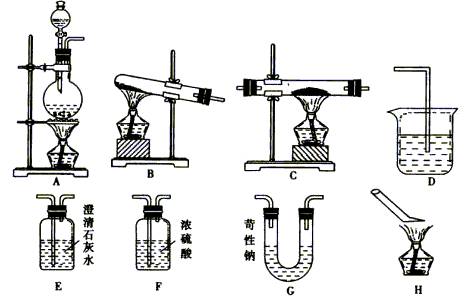
解析:在制取气体时,根据方程式:H2C2O4
![]() CO↑+CO2↑+H2O,可知这是一个固体与液体物质在加热条件下制取气体的反应,应选装置A。
CO↑+CO2↑+H2O,可知这是一个固体与液体物质在加热条件下制取气体的反应,应选装置A。
因为草酸在加热中分解生成CO时,同时有CO2 和H2O生成,若不除去则影响CO还原性和进行氧化产物CO2 的鉴定。可选用装有苛性钠的U型管以吸收混合气体中的CO2 ,同时还要配以装有澄清石灰水的装置E。当气体通过G装置后进行装置E无浑浊出现,说明混合气体中CO2 已除尽,然后通过装有浓H2SO4
的洗气瓶进行干燥,才能进入装置C与![]() 反应,证明CO的还原性。
反应,证明CO的还原性。
在C中反应生成Fe和CO2 ,证明生成了CO2 ,只能再次选用装置E,其中溶液在气体通过后出现浑浊,证明在反应中已生成了CO2 ,这就说明了CO的还原性,CO在反应中被氧化为CO2 ,剩余CO不能向空气中排放,无其他试剂可以将其吸收,所以将尾气在H处点燃,使未反应的CO转化为CO2 。
实验中有三处装置使用酒精灯,即A、C、H。正确操作点燃酒精灯的顺序应为A→H→C。使分解产生的气体将系统内的空气排净,防止加热时发生爆炸,而熄灭酒精灯的顺序应为C→A→H。这是因为要使已被还原的铁粉在CO的气流中冷却,以防止再被氧化影响实验结果。
实验最后给出测定的有关数值,要求确定![]() 中的
中的![]() 和
和![]() 值:
值:
![]()
![]()
![]()
![]()
![]()
![]() 中含氧原子的物质的量:
中含氧原子的物质的量:
![]()
![]()
![]() ,故
,故![]()
答案:(1)A→G→E→F→C→E→H(2)a.草酸分解气体通过装置E时无白色沉淀生成说明其中所含CO2 已除尽,通过装置C反应后气体通过第二个装置E时出现白色沉淀,说明CO的氧化产物为CO2 。b.尾气在装置H处点燃,使剩余的CO转化为CO2
(3)![]()
![]()
![]()
(4)A→H→C,使分解产生的气体把实验系统内的空气排尽,防止加热时引起爆炸
C→A→H,使热的铁粉在CO气流中冷却,防止铁粉再次被氧化
(5)2、3
知能训练
一、选择题
1.(2002全国理综,6)以下说法正确的是
A.纳米材料是一种称为"纳米"的新物质制成的材料
B.绿色食品是指不含任何化学物质的食品
C.生物固氮是指植物通过叶面直接吸收空气中的氮气
D.光导纤维是以二氧化硅为主要原料制成的
2.(2004上海,大综)玻璃的主要成分之一是二氧化硅。能在玻璃上进行刻蚀,将其制成毛玻璃和雕花玻璃的物质是
A、烧碱 B、纯碱 C 、氢氟酸 D、 盐酸
3.(2001春季,5)下列氧化物按其形成的含氧酸酸性递增顺序排列的是
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
4.对于碳族元素,下列说法正确的是
A.锗、硅元素的单质都是半导体材料 B.CH4、SiH4、GeH4的稳定性依次减弱
C.H2CO3、H2SiO3、H2GeO3的酸性依次增强 D.C、Si、Ge、Sn、Pb的熔、沸点依次升高
5.下列说法:①硅化学性质很稳定,因此硅在自然界中以游离态形式存在;②硅和二氧化硅晶体都属于原子晶体;③二氧化硅和二氧化碳在物理性质上有很大的差异;④二氧化硅是一种酸性氧化物,它不与任何酸发生反应。正确的是
A.①②③④ B.①②④ C.①④ D.②③
6.二氧化硅属于酸性氧化物的理由主要是
A.硅是非金属元素 B.二氧化硅对应的水化物是可溶性弱酸
C.二氧化硅能与强碱反应生成盐和水 D.二氧化硅不能与酸反应
7.某混合气体中可能含有H2、CO、CO2、HCl、NH3、和H2O (气)中的两种或多种,当混合气体依次通过① 澄清石灰水(无浑浊现象),② Ba(OH)2溶液(有浑浊现象),③ 浓H2SO4(无现象),④ 灼烧氧化铜(变红),⑤ 无水CuSO4(变蓝)。对该混合气体成分正确判断的是
A.一定没有CO2,肯定有H2 B.一定有CO、CO2、H2O(气)
C.一定有H2、CO2、HCl D.可能有CO2、NH3、H2O(气)
8.将标准状况下2.24 L CO2通入150 mL 1mol·L-1NaOH溶液中,下列说法正确的是
A.c(HCO3-)略大于c( CO32-) B.能使酸性高锰酸钾溶液褪色
C.c(Na+)等于c( CO32-)与c( HCO3-)之和 D.c( HCO3-)略小于c( CO32-)
9.下列离子方程式,正确的是
A.澄清石灰水通人过量二氧化碳:Ca2+ +2OH-+CO2 = CaCO3↓+H2O
B.硅酸钠溶液中通人足量二氧化碳:SiO32-+2CO2+3H2O = H4SiO4↓+2HCO3-
C.二氧化硅与烧碱溶液反应:SiO2 +2OH-= SiO32-+H2O
D.硅酸与烧碱溶液中和:H+ + OH-= H2O
10.如果发现114号新元素X,则下列可能具有的性质合理的是
A.X是非金属元素 B.X有稳定的氢化物
C.X的+4价化合物比+2价化合物稳定 D.XO2具有强氧化性
11.下列各组离子中能大量存在的是
A.K+、SiO32-、OH-、Na+ B. Na+、H+、CO32-、SO42-
C.K+、H+、SiO32-、Cl- D.OH-、Na+、HCO3-、Cl-
12.下列5个转化,其中不能通过一步反应实现的是
① SiO2 → Na2SiO3 ② CuSO4 → CuCl2 ③ SiO2 → H2SiO3 ④ CuO → Cu(OH)2 ⑤ Na2O2 → Na2SO4
A.① ② B.③ ④ C.② ③ ④ D.② ③ ④ ⑤
13.高岭土的组成可表示为Al2Si2Ox(OH)y ,其中x、y的数值分别是
A.7、2 B.5、4 C.6、3 D.3、6
二、填空题
14.Fe3O4可以写成FeO·Fe2O3,若看作一种盐时,又可写成Fe(FeO2)2。根据化合价规律
和这种书写方法,则Pb3O4的氧化物形式为 ,盐的形式为 。等物质的量的Fe3O4和Pb3O4分别和浓盐酸时,所消耗HCl的物质的量相等,不同的是,高价的铅能将盐酸氧化而放出氯气。试写出Fe3O4、Pb3O4分别和浓盐酸反应的方程式 , 。
15.一固体单质A加入NaOH溶液生成单质气体B和化合物甲,气体B和单质C在一定条件下反应生成化合物乙,化合物甲加入过量盐酸生成白色胶状物质丙,丙彻底脱去化合物乙生成难溶物丁,丁加入NaOH又可生成化合物甲。写出上述物质的化学式: A ,B ,C ,甲 ,乙 ,丙 ,丁 。写出A与NaOH反应的化学方程式: 。写出甲与盐酸反应的离子方程式: 。
16.有三种不同质量比的氧化铜与炭粉的混合物样品①、②、③。甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中氧化铜的量。
(1)甲取样品①强热,若所得固体为金属铜,将其置于足量的稀硝酸中微热,产生1.12 L气体(标准状况),则样品①中氧化铜的质量为 g。
(2)乙取样品② a g强热,生成的气体不能使澄清的石灰水变浑浊。再将反应后的固体与足量的稀硝酸微热,充分反应后,有b g固体剩余,该剩余固体的化学式为 。样品②中氧化铜质量为 g(以含a、b的代数式表示)。
(3)丙称量样品③强热后剩余的固体,质量比原样品减小了c g,若该固体为金属铜,则样品③中氧化铜物质的量(n)的取值范围为 。
三、计算题
17.向300mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出。
(2)若通入CO2气体为2.24L(标准状况下),得到11.9g的白色团体。请通过计算确定此
白色固体是由哪些物质组成的,其质量各为多少?所用的KOH溶液溶质的物质的量浓度为多少?
参考答案:
1.D 2.C 3.B4.AB 5.D 6.C 6.C 8.A 9.BC 10.D 11.A 12.B 13.B
14.2PbO·PbO2 Pb2PbO4 Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,Pb3O4+8HCl=3PbCl2+Cl2↑+4H2O
15.Si H2 O2 Na2SiO3 H2O H4SiO4 SiO2
Si+2NaOH+ H2O= Na2SiO3+ 2H2↑ SiO32-+2H++H2O==H4SiO4↓
16.(1)6.0 (2)C;![]() (3)
(3)![]()
17.(1)①K2CO3和KOH ②K2CO3 ③K2CO3和KHCO3 ④KHCO3(2)白色固体由K2CO3和KHCO3组成, 其质量各为6.90g和5.00g 0.500 mol•L-1