08届高三年级理综化学部分第二次模拟考试
理科综合能力测试 (化学部分)
一、选择题(每小题只有一个选项符合题意)
6.关于用惰性电极电解氯化钠溶液的实验,下列叙述正确的是
A.电解时在阳极得到氯气,在阴极得到钠
B.若在阳极附近的溶液中滴入淀粉KI溶液,溶液呈蓝色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
7.若NA代表阿伏加德罗常数的值,以下说法正确的是
A.9g重水含有的电子数为5NA
B.1molMgCl2中含有的离子数为NA
C.7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA
D.1molC10H22分子中共价键总数为31 NA
8.pH=3的盐酸aL分别与下列3种溶液充分混合后溶液呈中性:①pH=11的氨水bL;②物质的量浓度为10-3mol/L的氨水cL;③c(OH-)=10-3mol/L的Ba(OH)2溶液dL。试判断a、b、c、d的大小关系为
A.a=b>c>d B.b>a=d>c C.c>a>d>b D. c>a=d>b
9.在含有FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O2固体,充分反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是
A.Na+ B.Al3+ C.Fe3+ D.Fe2+
![]() 10.将1molSO2和1molO2通入一容积固定密闭容器中,在一定条件下反应2SO2(g)+O2(g) 2SO3(g)达到平衡时,n(SO3)=0.3mol,若保持温度不变,移走0.5mol SO2和0.5mol O2,则重新达到平衡时,SO3的物质的量
10.将1molSO2和1molO2通入一容积固定密闭容器中,在一定条件下反应2SO2(g)+O2(g) 2SO3(g)达到平衡时,n(SO3)=0.3mol,若保持温度不变,移走0.5mol SO2和0.5mol O2,则重新达到平衡时,SO3的物质的量
A.等于0.3mol B.等于0.15 mol C.大于0.15 mol D.小于0.15 mol
11.已知M2O2- n可把R2-氧化为R单质,变为M2+。又知c(M2O2- n)=0.3mol/L的溶液100mL,可与c(R2-)=0.6mol/L的溶液150mL恰好完全反应,则n值为
A.7 B.6 C.5 D.4
12.下列反应的离子方程式书写正确的是
A.H2O2和酸性FeCl2溶液反应:2Fe2++H2O2+2H+=2 Fe3++2H2O
B.硫化钠水解:S2-+H2O=HS-+OH-
C.碳酸钙与醋酸溶液反应:CO2- 3+2CH3COOH=2CH3COO-+CO2↑+H2O
![]() D.向氢氧化钠溶液中通入少量的CO2:OH-+CO2=HCO- 3
D.向氢氧化钠溶液中通入少量的CO2:OH-+CO2=HCO- 3
13.现有乳酸(CH3―CH―COOH)和乙醇的混合物共1mol,完全燃烧生成54g水和56LCO2(标准状况下测定),则其消耗氧气的物质的量为
A.2 mol B.2.25 mol C.3 mol D.3.75 mol
26.(15分)A、B、C、D、E5种短周期元素,原子序数依次增大。已知:
①A与B可形成原子个数比为1:1、2:1、3:1等多种气态化合物;
②B和D可形成BD2- 3或B2D2- 4;
③E的二价阳离子与D的阴离子具有相同的电子层结构。
请回答下列问题:
⑴A元素的名称是_____,C元素的元素符号为_______。
⑵A和D可形成两种化合物的化学式分别为__________和__________。
⑶E的单质与BD2发生反应的化学方程式为____________________________________。
⑷将CD2放入一密闭容器,在一定条件下测定其相对分子质量,结果发现测得的数值总是比按CD2化学式计算所得的数值大幅偏高,其原因是____________________________________
__________________________________________________________________。
⑸B单质的一种同素异形体呈空间网状结构,则该晶体结构中最小环上含有___个B原子。
27.(15分)A、B、C、D、E5瓶溶液,分别是AlCl3、BaCl2、NaHSO4、K2CO3、AgNO3中的一种。已知:
①A与B反应有气体产生 ②B与C反应有沉淀生成
③C与D反应有沉淀生成 ④D与E反应有沉淀生成
⑤A与E反应有气体生成 ⑥在②和③发反应中生成的沉淀是同一物质
请填写下列空白:
⑴A是____________,B是____________,D是______________。
⑵向C溶液中逐滴滴加过量稀氨水,在整个过程中出现的现象是___________________。
⑶将0.1mol/L的E溶液与0.1mol/L的Ba(OH)2溶液按下表中甲、乙、丙、丁、戊不同方式混合:
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 0.1mol/L的Ba(OH)2溶液的体积/mL | 10 | 10 | 10 | 10 | 10 |
| 0.1mol/L的E溶液的体积/mL | 5 | 10 | 15 | 20 | 25 |
①按丁方式混合后,所得溶液显________(填“酸”、“碱”、“中”)性。
②写出按乙方式混合时,反应的离子方程式为________________________________。
③25℃时,按甲方式混合后,所得溶液的pH为________。
28.(14分)某学生课外活动小组为了证明和比较二氧化硫和氯气的漂白性,设计了如下图所示的实验装置。
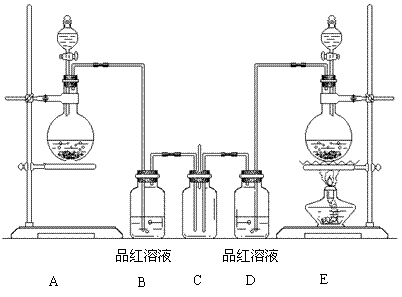
请回答下列问题:
⑴实验室制取氯气的化学方程式为________________________________________。
⑵实验室常用浓硫酸与亚硫酸钠固体反应制取二氧化硫,则其反应装置为上图中的____(填写字母代号),不用稀硫酸与亚硫酸钠溶液制取二氧化硫的理由是________________________
____________________________。
⑶装置C中试剂的名称及作用是____________________________________________。
⑷反应开始后,发现B、D两个装置中的品红溶液都褪色。请设计一个简单实验,证明二氧化硫和氯气漂白品红溶液的原理不同,实验方法、预期的现象和结论为________________
_____________________________________________________________________________
__________________________________________。
⑸若将B、D装置中的品红溶液换为滴有酚酞的氢氧化钠溶液,反应一段时间后,B、D中的现象是_____________________________________________________________________。
⑹实验结束后,经检验,发现装置C中的溶液呈碱性,并且含有SO2- 4。试写出C中生成
SO2- 4的离子方程式(有多种可能,只写出一个即可)______________________________。
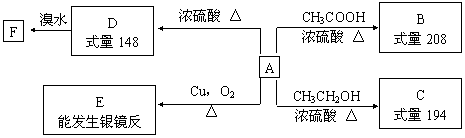 29.(16分)某芳香族化合物A,苯环上只有一个取代基,完全燃烧只生成二氧化碳和水,一定条件下存在如下图所示的转化关系:
29.(16分)某芳香族化合物A,苯环上只有一个取代基,完全燃烧只生成二氧化碳和水,一定条件下存在如下图所示的转化关系:
请回答下列问题:
⑴A的摩尔质量为___________,在一定条件下B可能发生的化学反应的类型有_______(填序号)。
①水解反应。②取代反应。③加成反应。④消去反应。⑤加聚反应。
⑵C的结构简式为_______________,E的结构简式为_________________。
⑶写出下列转化的化学方程式:
①A→B:______________________________________________________________。
②D→F:______________________________________________________________。
⑷符合下列三个条件的A的同分异构体的数目有____个
①含有二取代苯环结构。②与A有相同的官能团。③能与FeCl3溶液发生显色反应。
高三年级第二次模拟考试
理科综合能力测试 (化学部分答案)
6.B 7.D 8.D 9.B 10.D 11.A 12.A 13.C
26.(共15分)
⑴氢 N(每空2分,共4分)
|
⑶2Mg+CO2 2MgO+C(2分)
![]() ⑷存在化学平衡2NO2 N2O4,所测得的结果实际上是NO2和N2O4混合气体的平均相对分子质量。(3分,其它合理答案也可得分)
⑷存在化学平衡2NO2 N2O4,所测得的结果实际上是NO2和N2O4混合气体的平均相对分子质量。(3分,其它合理答案也可得分)
⑸6(2分)
27. (共15分)
⑴K2CO3 AlCl3 BaCl2(每空2分,共6分)
⑵产生白色沉淀,后沉淀逐渐溶解(2分,其它合理答案也可得分)
⑶①中(2分)
②Ba2++OH-+H++SO2- 4=BaSO4↓+H2O(3分)
③13(2分)
|
⑴MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O(2分)
⑵A(1分)
SO2易溶于水(1分,其它合理答案也可得分)
⑶氢氧化钠溶液 吸收尾气中的氯气和二氧化硫(2分,其它合理答案也可得分)
⑷分别取少量褪色后的溶液于试管中,用酒精灯加热,经二氧化硫漂白的品红溶液恢复红色,说明二氧化硫与品红溶液结合成不稳定的无色物质;经氯气漂白的品红溶液不变红,说明氯气将品红溶液氧化褪色。(3分,其它合理答案也可得分)
⑸B、D装置中的红色均褪去。(2分,其它合理答案也可得分)
⑹Cl2+SO2- 3+H2O=SO2- 4+2Cl-+2H+
Cl2+SO2+4OH-=SO2- 4+2Cl-+2 H2O
ClO-+SO2- 3=SO2- 4+2Cl-(3分,任写一种,其它合理答案也可得分)
29.(共16分)
⑴166g/mol(2分,不写单位不给分)
①②③(2分,有错不给分)
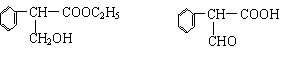 |
⑵
(每空2分,共4分)
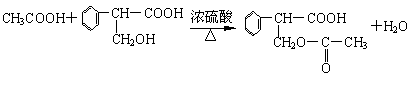 ⑶
⑶
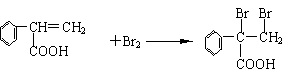 |
(每空3分,共6分)
⑷6(2分)