高三化学上册第三次月考试题
考试时间:80min 总分:108分
命题人:刘维国
可能用到的相对原子质量:H 1、C 12、O16、Mg24、Fe56、Cu64、Ag108
一、选择题 :(共16个小题,每小题3分,共48分,每小题只有一个选项符合题意)
1、将纯水加热至较高温度,下列叙述正确的是( )
A、水的离子积变大、PH变小、呈酸性 B、水的离子积不变、PH不变、呈中性
C、水的离子积变小、PH变大、呈碱性 D、水的离子积变大、PH变小、呈中性
2、在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是(
)
2AB(g)达到平衡的标志是(
)
A单位时间内生成n mol的A2同时生成n mol的AB
B、容器内的总压不随时间变化
C、单位时间内生成2n mol的A2同时生成n mol的B
D、单位时间内生成n mol的A2同时生成n mol的B2
![]() 3、下列反应式表示氨既有还原性又有碱性的是( )
3、下列反应式表示氨既有还原性又有碱性的是( )
![]() A、4NH3 + 3O2 6H2O + 2N2 B、NH3 + NH3 = NH4+ +NH2-
A、4NH3 + 3O2 6H2O + 2N2 B、NH3 + NH3 = NH4+ +NH2-
C、8NH3
+ 3 Cl2 = 6NH4Cl + N2 D、2NH3 + 3CuO ![]() 3Cu
+ 3H2O + N2
3Cu
+ 3H2O + N2
4、C60被称为“分子足球”;最近日本科学家确认世界上还存在一种“分子足球N60”,它与C60的结构相似,而且在高温或机械撞击后,其中积蓄的巨大能量会在一瞬间释放出来。对于N60下列说法中正确的是 ( )
A、N60是化合物,不是单质 B、N60与14N都是氮的同位素
C、N60 没有同素异形体
D、N60的发现开辟了能源的新天地,将来会成为较好的火箭燃料
5、在实际生产中,反应2SO2 + O2 ![]() 2SO3
;△H<0 ,应选择的适宜条件是(
)
2SO3
;△H<0 ,应选择的适宜条件是(
)
A、高温、高压、催化剂 B、低温、高压、催化剂
C、高温、低压、催化剂 D、适当温度、常压、催化剂
6、某些保健品中有锗元素(Ge),它在周期表的第四周期ⅣA族。有关锗叙述正确的是( )
A、锗原子序数为34 B、Ge可以生成化学式为Na2GeO3的盐
C、锗的金属活动性比钠强 D、单质锗是导体
7、下列各组离子能大量共存,当溶液中c(H+) = 0·1mol·L-1时,有气体产生;而当溶液中c(H+) = 10-13 mol·L-1时,又一定能生成沉淀。该组离子是( )
A、Na+、Cu2+、NO3-、CO32- B、Ba2+、K+、 Cl-、HCO3-
C 、Fe2+、Na+、SO42-、NO3- D、 Mg2+、NH4+、SO42-、 Cl-
8、在100℃时,将PH = 12的NaOH 溶液a L与PH = 1的硫酸溶液b L混合,若所得混合溶液的PH = 11,则a:b为(已知:100℃时,水的离子积为10-12) ( )
A、2 :9 B、101 :9 C、9 :2 D、9 :101
9、在20mLPH=2的醋酸溶液中,加入VmLPH=12的NaOH 溶液。则下列说法正确的是( ) A、如果V=20,则所得混合溶液的PH大于7
B、当V=20时,混合溶液中离子浓度大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C、如果所得混合溶液的PH=7,则V小于20
D、所得混合溶液中一定存在c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-)
10、 下列不正确说法的组合最确切的是( )
① 碳族元素包括:碳、硅、锗、硒、铅五种元素
② 碳族元素的最高价氧化物对应水化物都是酸
③ 碳族元素单质的熔、沸点随原子序数递增而升高
④ 碳族元素都有+2、+4价化合物,且都是+4价化合物比较稳定
A、①③ B、②③④ C、①②③ D、①②③④
11、把3体积的NO2气体,依次通过下列3个分别装有①NaHCO3饱和溶液② 浓H2SO4③ Na2O2的装置,用排水法把残留气体收集到集气瓶中,集气瓶内气体应是(同温同压下测定)
A、1体积NO B、2体积NO2和0.5体积O2 C、2体积O2 D、0.25体积O2
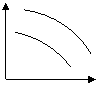
12、在某容积一定的密闭容器,可逆反应A(气)+B(气)![]() XC(气),符合下列图象I所示关系,由此推断对图Ⅱ的正确说法是(
)
XC(气),符合下列图象I所示关系,由此推断对图Ⅱ的正确说法是(
)
A、P3<P4,Y轴表示A的转化率 B、P3<P4,Y轴表示B的百分含量
C、P3>P4,Y轴表示混合气体的密度 D、P3>P4,Y轴表示混合气体的平均摩尔质量
 C% Y
C% Y
![]() c
c
![]()
![]()
![]() b
b
![]() a P4
a P4
![]()
T
13、将4.9克Mg和Fe的混合物溶解在过量的稀HNO3溶液中,完全放应得到标况下气体2.24L,则反应后的溶液中加入足量的烧碱,则生成沉淀的质量是 ( )
A、6g B、8g C、10g D、12g
14、在恒温、恒容的条件下,又反应2X(g) + 2Y(g) ![]() Z(g) + 3M(g),现从两条途径分别建立平衡。途径I:X、Y的起始浓度均为2mol·L-1 ;途径Ⅱ:Z、M的起始浓度分别为2mol·L-1和6mol·L-1。则以下叙述正确的是 (
)
Z(g) + 3M(g),现从两条途径分别建立平衡。途径I:X、Y的起始浓度均为2mol·L-1 ;途径Ⅱ:Z、M的起始浓度分别为2mol·L-1和6mol·L-1。则以下叙述正确的是 (
)
A、途径达平衡时,体系内混合气体的体积组成不相同
B、两途径达平衡时,体系内混合气体的平均相对分子质量相同
C、平衡时,途径I的反应速率V(X)等于途径Ⅱ的反应速率V(Y)
D、平衡时,途径I所得混合气体的密度与途径Ⅱ所得混合气体的密度相等
15、一定量的Fe粉与400mL 1mol/LHNO3溶液恰好完全反应,还原产物为NO,对此,下列说法正确的是( )
A、生成的溶液一定呈黄色 B、被还原的HNO3的物质的量为0.1mol
C、氧化产物的物质的量一定为0.1mol D、参加反应的Fe粉的质量一定为5.6g
16、下列各式中属盐的水解反应的是( )
A、HS-+H2O![]() H3O++S2- B、HS-+H2O
H3O++S2- B、HS-+H2O![]() H2S+OH-
H2S+OH-
C、HS-+H3O+==H2S↑+H2O D、CO32-+H2O+CO2==2HCO3-
二、填空题:
17、(9分)分别设计化学实验,用最佳方法证明明矾溶于水时发生的下列变化:
选用的药品仪器:明矾溶液、甲基橙试液、石蕊试液、酚酞试液、PH试纸、氢氧化钠溶液、酒精灯、半透膜、电泳仪、聚光束仪。
①证明明矾发生了水解反应____________________。
②证明其水解反应是一个吸热反应___________________。
③证明生成了胶体溶液________________________。
18、(14分)反应mA(g)+nB(g)![]() pC(g)+qD(g)达到平衡后:
pC(g)+qD(g)达到平衡后:
① 增大压强平衡向左移动,则m+n__p+q(填“>”“<”或“=”)。
② 若向反应混合物中加入适量的B,则A的转化率__,B的转化率__,C的产率
__。(填“增大”“减小”或“不变”)
③ 若扩大容器体积,速率变化为:V(正)__,V(逆)__。
④ 若该反应为吸热反应,且m+n=p+q,要使达到平衡所需时间缩短,且不影响原平衡状态,可采取的措施有__。
19、(12分)已知A、B、C、D均为化合物,B、C常温常压下为气体,C气体可使湿润的红色石蕊试纸变蓝色;又知1mol A在200℃时分解仅得1mol B和一定量的水两种产物,A中含有NO3-。A、B、C、D间有如下关系:

![]()
![]() ① ②
① ②
试回答下列问题:
① 写出A、C的化学式:A______、C______。
② 写出反应①的离子方程式:_________。
③ 写出反应②的化学方程式,并标出电子的转移方向和数目:______。
三、实验题:
20、(16分)2005年11月,美国科学家们经过研究发现,分布在萤火虫呼吸道上的细胞能够制造一氧化氮,来自大脑的信号则控制释放一氧化氮,一氧化氮致使被称为线粒体的邻近细胞结构短暂地关闭。线粒体关闭时会产生一个氧脉冲,氧脉冲则引发另一个细胞中的一种酶打开萤火虫的“灯泡”。整个闪光过程在千分之一秒内即可完成。这次的发现再次验证了一氧化氮在生物机体内的重要作用。
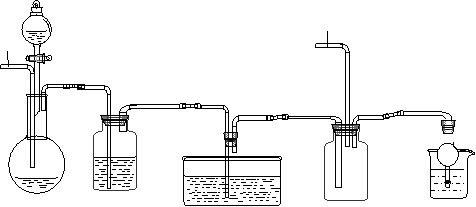
下图为某实验者设计的验证银元完全溶解于一定量的浓硝酸,生成的NO2气体中含有NO的实验装置图。
常温下,NO2与N2O4混合存在;在低于0℃时,几乎只有无色N2O4晶体存在。
 |
氧气→K2
氧气→ K1
![]()
![]()
![]()
![]()
![]() ,
,
浓 冰
![]()
![]() A 硫B 盐C D E
A 硫B 盐C D E
![]()
![]() 银元0 酸 水 NaOH溶液
银元0 酸 水 NaOH溶液
⑴反应前先打开A部分的活塞K1,持续通一段时间N2,其理由是________________________________。
⑵若装置中缺B部分,其后果是______________________。
⑶反应结束后,打开D部分的活塞K2,并通入氧气,D瓶内气体由无色变为棕色;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因是_________
________________________________。
⑷C部分装置的作用是________;E部分中a仪器所起的作用是____。
⑸已知该银元的质量为25g,加入75mL 12mol/L的浓硝酸。实验结束后,A部分烧瓶内溶液中H+的浓度为2mol/L(反应中HNO3既无挥发也无分解),溶液体积仍为75mL。为测定该银元中铜的质量分数,还须进行的主要实验操作是_______。
四、计算题:(9分)
21、将23.9g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入120mL一定浓度的硝酸中,充分反应后,硝酸被还原成NO2和NO,反应后溶液中H+为0.160mol。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤、干燥后得到29.4g蓝色固体。求:
①铜片中单质铜的质量分数;
②铜片与硝酸充分反应后,溶液中NO3-的物质的量浓度(假设反应前后溶液的体积不变)。
班级:________ 姓名:____________ 考号:___________ 总分:____________
高三第三次月考化学答题卡
一、选择题:(16×3分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| D | C | C | D | D | B | B | A | D | D | D | D | C | B | B | B |
二、填空题:
17、(9分)
①_用PH试纸测溶液的PH值如小于7则明矾发生了水解.
②-向溶液滴入几滴甲基橙用酒精灯加热如溶液由橙色变为红色则该反应为吸热反应.
③_用聚光仪照射溶液如有光的通路则证明为胶体.
18、(14分)
①<. ②增大,减小,增大. ③减小, 减小.④缩小体积、加催化剂.
19、(12分)
①A NH4NO3, C NH3
② NH4+ + OH- = NH3↑ + H2O。
③ NH4NO3 = N2O ↑ + 2H2O 。
20、(15分)
⑴_排除系统内空气,防止生成的NO被空气中的氧气氧化_。
⑵ C中水蒸气冷却呈液态,与NO2或N2O4反应生成NO干扰NO验证。
⑶_NO生成NO2 气体由无色变为红棕色。升温使2 NO2 ![]() N2O4 平衡左移,NO2浓度增大,颜色加深。
N2O4 平衡左移,NO2浓度增大,颜色加深。
⑷_使NO2全部转化为N2O4液态或晶体;防倒吸,尾气收集。
⑸ 将A中液体倒入烧杯中,再加过量的NaCl溶液,过滤,洗涤、干燥、称量,测定溶液中Ag+的质量。
21、(10分)
① 53.6% ② 6.33mol/L