高三化学上学期抽样测试试卷
高三化学试卷
说明:1.本试卷满分100分,考试时间120分钟。
2.请将选择题答在第4页答卷纸上。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Cl—35.5 Cu—64
一、选择题(每小题只有一个正确选项,1~10小题,每题2分;11~18小题,每题3分,共44分)
1.化学与人们的生活、健康密切相关。下列做法不合理的是 ( )
A.用米汤检验加碘食盐中的碘酸钾(KIO3)
B.向豆浆中加入盐卤(主要成分为MgCl2)制做豆腐
C.用灼烧和闻气味的方法区别棉织物和纯毛织物
D.用透析的手段净化尿毒症患者的血液
2.下列物质中既含极性共价键又含非极性共价键的是 ( )
A.N2 B.H2O C.Na2O2 D.H2O2
3.考古学家可以通过测定古生物化石中14C的含量确定古生物生活的年代。下列关于14C的
说法正确的是 ( )
A.与12C化学性质不同 B.与C60互为同素异形体
C.与12C互为同位素 D.与14N含有的中子数相同
4.25℃时,在pH=13的溶液中可以大量共存的离子组是 ( )
A.K+、Na+、HCO3—、NO3— B.Na+、K+、SO42—、Cl—
C.H+、Mg2+、SO42—、NO3— D.Ag+、K+、NO3—、Na+
|
|
|
|
C.Fe3O4+4CO 3Fe+4CO2 D.2HgO 2Hg+O2↑
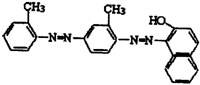
6.卫生部下发紧急通知要求查处苏丹红“红心鸭蛋”。被查处的所谓“红心鸭蛋”是有人将
|
害的苏丹红。“苏丹红4号”的结构简式为: 。下列关
于“苏丹红4号” 说法错误的是 ( )
A.能发生加成反应 B.分子式为C24H20N4O
C.能被酸性高锰酸钾溶液氧化 D.属于苯的同系物
7.二氧化硫的催化氧化是放热反应。下列关于接触法制硫酸的叙述中正确的是 ( )
A.为防止催化剂中毒,炉气在进入接触室之前需要净化
B.为提高SO2的转化率,接触室内反应温度选定在400℃~500℃
C.为防止污染大气,从哪收塔出来的尾气常用NaOH溶液吸收
D.为提高SO3的吸收效率,用稀硫酸代替水吸收SO3
8.下列反应的离子方程式书写不正确的是 ( )
![]() A.硫酸铜水解:Cu2+2H2O Cu(OH)2+2H+
A.硫酸铜水解:Cu2+2H2O Cu(OH)2+2H+
B.澄清石灰水与少量小苏打溶液混合:Ca2++2OH—+2HCO3—=CaCO3↓+CO32—+2H2O
C.氯化铝溶液加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.NaHSO4溶液中滴加NaHCO3溶液:H++HCO3—=H2O+CO2↑
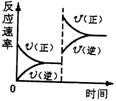
![]() 9.对于达到平衡的可逆反应:X+Y W+Z,其他条件不变时,增大压强,正、逆反应
9.对于达到平衡的可逆反应:X+Y W+Z,其他条件不变时,增大压强,正、逆反应
|
四种物质状态的描述正确的是 ( )
A.W、Z均为气体,X、Y中只有一种为气体
B.X、Y均为气体,W、Z中只有一种为气体
| |
D.X、Y均为气体,W、Z均为液体或固体
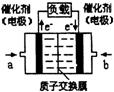
|
下列说法不正确的是 ( )
A.右电极为电池正极,b处通入的物质是空气
B.左电极为电池负极,a处通入的物质是空气
C.负极反应式为:CH3OH+H2O-6e—=CO2+6H+
D.正极反应式为:O2+4H++4e—=2H2O
11.下列物质发生变化时,所克服的粒子间相互作用属同种类型的是 ( )
A.金属钠与固态水分别受热熔化 B.氯化铵与苯分别受热变为气体
C.氯化钠与氯化氢分别溶解在水中 D.碘与干冰分别受热变为气体
12.在允许加热条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铝和硫酸铁溶液,这种试剂是 ( )
A.AgNO3 B.BaCl3 C.NaOH D.NH3·H2O
13.NA表示阿伏加德罗常数,下列说法中正确的是 ( )
A.常温常压下,7.1g Cl2含有的Cl2分子数为0.2NA
B.0.1mol羟基(-OH)含有的电子数为NA
C.1.7g NH3含有的电子数为NA
D.标准状况下,11.2L SO3中含有的氧原子数为1.5 NA
14.向含Fe3+、Fe2+、Mg2+、NH4+的水溶液中,加入足量的Na2O2固体,充分反应后再加入过量的稀盐酸,上述离子数目没有变化的是 ( )
A.Fe2+ B.NH4+ C.Fe3+ D.Mg2+
15.元素周期表中的短周期元素X和Y,可组成化合物XY3,下列说法正确的是 ( )
A.XY3一定是离子化合物
B.若Y的原子序数为m,则X的原子序数一定为m±4
C.X和Y可属同一周期,也可属不同周期
D.X和Y一定不属于同一主族
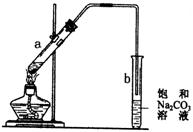
16.右图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是( )
|
边慢慢加入乙醇,再冰醋酸
B.试管b中导气管下端管口不能浸入液面的目
的是防止实验过程中产生倒吸现象
C.实验时加入试管a的目的之一是及时将乙酸
乙酯蒸出,使平衡向生成乙酸乙酯的方向移动
D.试管b中饱和Na2CO3溶液的作用是吸收随乙
酸乙酯蒸出的少量乙酸和乙醇
17.25℃时,某溶液中由水电离产生的c(H+)和c(OH—)的乘积为1×10—18,下列说法正确的是 ( )
A.该溶液的pH可能是7 B.此溶液不存在
C.该溶液的pH一定是9 D.该溶液可能pH=5
18.某温度下,向50g水中加入m g CuSO4或加入n g CuSO4·5H2O,均可使溶液恰好达到饱和,则m与n的关系为 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
| |
19.(4分)铁酸钠(化学式为Na2FeO4)是一种新型净水剂,工业上常通过如下化学反应制取:Fe2O3+3NaNO3+4NaOH=2Na2FeO4+3NaNO2+2H2O。
(1)反庆中,氧化剂为 。
(2)当生成4mol Na2FeO4时,电子转移总数为 mol。
20.(6分)目前世界上比较先进的电解制碱技术是离子交换膜法。
(1)电解法制烧碱的主要原料是饱和食盐水。由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO![]() 等杂质,因此必须经过精致才能进行电解。除去这些杂质时,不应选用的试剂是
(填序号)。
等杂质,因此必须经过精致才能进行电解。除去这些杂质时,不应选用的试剂是
(填序号)。
a.BaCl2 b.Na2CO3 c.NaOH d.盐酸 e.KOH
(2)现有200mL食盐水,用石墨电极电解。当阴极产生气体的体积为0.224L(标准状况)时停止电解,阳极的电极反应式为 ,电解后,溶液在常温下的pH约为 (忽略体积变化)。
三、(本题包括2小题,共20分)
21.(10分)A、B、C、D、E为短周期元素,原子序数依次增大。其中A与E同主族,B的最外层电子数是次外层电子数的2倍,C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X。A、B、D、E可组成化合物A2D2、B2A2、E2D2,它们都含有非极性共价键。
(1)C元素在周期表中的位置是 ,写出B的最高价氧化物的电子式 。
(2)X的水溶液显 (填“酸”、“碱”或“中”)性,理由是(用离子方程式表示) ,溶液中各种离子浓度由大到小的顺序为 。
(3)A、B、D、E四种元素组成的化合物中原子个数最少的化合物的化学式为 。
(4)炎箭推进器中装有液态的C2A4和液态A2D2,它们发生化学反应时生成气态C单质和水蒸气,并放出大量热。已知0.4mol液态C2A4跟液态A2D2完全反应时,放出256.6kJ热量,该反应的热化方程式为 。
22.(10分)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略
|
试回答:
(1)若X是强氧化性单质,则A不可能是 。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为 ;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示) ,检验此C溶液中金属元素价态的操作方法是 。
(3)若A、B、C为含金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为 ,X的化学式可能为(写出不同类物质) 或 ,反应①的离子方程式为 或 。
四、(本题包括2小题,共16分)
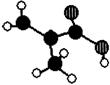
23.(8分)北京东方化工厂生产的某产品只含C、H、O三种元素,其分子模型如下图所示
|
(1)该产品的结构简式为 ,
分子式为 。
(2)下列物质中,与该产品互为同分异构体的是
(填序号),与该产品互为同系物的是
(填序号)。
①CH3CH=CHCOOH ②CH2=CHCOOCH3
③CH3CH2CH=CHCOOH ④CH3CH(CH3)COOH
(3)在一定条件下,该产品跟乙二醇反应可得到分子式为C6H10O3的物质,该物质发生加聚反应可得到用来制作隐形眼镜的高分子材料,这种高聚物的结构简式为 。
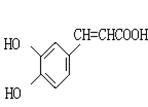
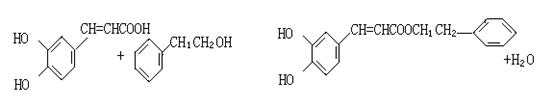
24.(8分)咖啡酸(下式中的A)是某种抗氧化剂成分之一,A与FeCl3溶液反应显紫色。
 |
(1)咖啡酸中含氧官能团的名称为 。
(2)咖啡酸可以发生的反应是 (填写序号)。
①氧化反应 ②加成反应 ③酯化反应 ④加聚反应 ⑤消去反应
(3)咖啡酸可看作1,3,4一三取代苯,其中两个相同的官能团位于邻位,取代基中不含支链。则咖啡酸的结构简式为 。
(4)3.6g咖啡酸与足量碳酸氢钠反应生成气体(标准状况) mL。
(5)蜂胶的主要活性成分为CPAE,分子式为C12H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇,且分子结构中无甲基,则咖啡跟该芳香醇在一定条件下反应生成CPAE的化学方程式为 。
五、(本题包括2小题,共10分)
25.(4分)12.0g某液态有机化合物A完全燃烧后,生成14.4gH2O和26.4g CO2。测得有机
化合物A的蒸气与H2的相对密度是30,求:
|
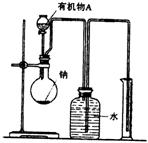
(2)用如图所示装置测定有机物A的分子结构,实验数
据如下(实验数据均已换算为标准状况):a mL(密
度为![]() g/cm3)的有机物A与足量钠完全反应后,量
g/cm3)的有机物A与足量钠完全反应后,量
筒液面读数为bmL,若1mol A分子中有x mol氢原
子能跟金属钠反应,则x的计算式为
(可以不化简)。
26.(6分)
|
N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol。达到平衡时,体积为反应前的三分之二。求:
(1)达到平衡时,N2的转化率为 。
(2)若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均>0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同,试比较反应放出的能量:
(1) (2)(填“>”、“<”或“=”)。
Ⅱ 若将2 molN2和4molH2放入起始体积相同的恒容容器中,在与I相同的温度下达到平衡。试比较平衡时NH3的浓度:Ⅰ Ⅱ(填“>”、“<”或“=”)。
参考答案
说明:其他正确答案可参照本标准给分。
一、选择题(1—10小题,每题2分;11—18小题,每题3分。共44分)
1.A 2.D 3.C 4.B 5.C 6.D 7.A 8.B 9.B
10.B 11.D 12.C 13.C 14.D 15.C 16.A 17.D 18.D
二、(本题包括2小题,共10分)
19.(4分)(1)NaNO3或硝酸钠
(2)12(2分)
20.(6分)(1)e(2分)
(2)2C1--2e-=C12↑(2分);13(2分)
|
21.(10分)
(1)第二周期 第VA族(1分);电子式: (1分)
![]() (2)酸性(1分)NH4++H2O NH3H2O+H+(2分);c(NO3—)>c(NH4+)>c(H+)>c(OH-)(2分)
(2)酸性(1分)NH4++H2O NH3H2O+H+(2分);c(NO3—)>c(NH4+)>c(H+)>c(OH-)(2分)
(3)HCOONa(1分)
(4)N2H4(1)+2H2O2(1)=N2(g)+4H2(g);△H=-641.5k/mol(2分)
22.(10分)
(1)de(1分)
(2)FeC13(1分);2Fe3++Fe=3Fe2-(1分)防止Fe2-被氧化(1分)
用试管取少量C溶液,滴加KSCN溶液,无颜色变化,再滴加氯水(或硝酸),溶液呈血红色,证明原溶液中有Fe2+存在。(1分)(答出要点可得分,其他正确答案参照本标准给分)
(3)A1(OH)3(1分);NaOH(或KOH)(1分);HC1(或其他强酸)(1分);
A13++3OH-=A1(OH)3↓(1分);A1O2-+H+H2O=A1(OH)3↓(1分)
(其他正确答案可参照本标准给分)
四、(本题包括2小题,共16分)
23.(8分)
(1)CH2=C(CH3)COOH(2分);C4H6O2(1分)
(2)①(1分)②(1分)③(1分)
(3)CH3
![]() [ C—CH2 ]
[ C—CH2 ]
COOCH2CH2OH(2分)
24.(8分)
|
(2)①②③④(1分)
(3) (1分)
|
(5)
(2分,条件、可逆号1分)
五、(本题包括2小题,共10分)
25.(4分)
(1)C3H8O(2分)
(2)![]() (2分)(其它部分化简的表达均可得分)
(2分)(其它部分化简的表达均可得分)
26.(6分)
(1)50%(2分);
(2)>(2分);
(3)>(2分)