高三化学上学期月考试卷(五)
化 学 试 题
时量:90分钟 满分:100分
可能用到的原子量:H:1 C:12 O:16 Si:28 C1:35.5 Na:23
Mg:24 A1:27 K:39
第Ⅰ卷(选择题,共51分)
一、选择题(共51分,每小题3分,每小题只有一个正确的选项)
1.某化合物易溶于水,但其水溶液不导电,则该化合物是 ( )
A.弱电解质 B.强电解质 C.非电解质 D.无法确定
2.将滴有甲基橙的醋酸钠饱和溶液加热,溶液的颜色是 ( )
A.橙色变为黄色 B.颜色不变
C.黄色变红色 D.黄色变橙色
3.光纤通信是20世纪70年代后期发展起来的一种新型通信技术,目前长距离光纤通信系
统已投入使用。光纤通信用的光学纤维是由下列哪种物物特殊工艺制成的 ( )
A.硅 B.石英 C.锗 D.碳
4.证明某溶液中可能含有Fe2+而不含Fe3+,进行如下实验,实验的最佳顺序为 ( )
①通入足量氯气 ②加入足量KMnO4溶液
③加入少量NH4SCN
A.①③ B.③② C.③① D.①②③
5.将某溶液逐滴滴入到Fe(OH)3胶体中,开始产生沉淀,继续滴加时沉淀又溶解,该溶
液是 ( )
A.2mol/L的H2SO4溶液 B.2mol/L的NaOH溶液
C.2mol/L的MgSO4溶液 D.硅酸胶体
6.下列反应的两种物质因为反应物用量不同或反应条件不同而生成不同的产物是 ( )
①Na和O2 ②H2S和O2 ③P和C12 ④CO2和NaOH
⑤Fe和HNO3 ⑥Fe和C12 ⑦Cu和S
A.全部 B.除⑤、⑦外 C.除①、⑦外 D.除⑥、⑦外
7.下列离子方程式正确的是 ( )
A.明矾溶液中滴加过量氨水
A13++4NH3·H2O A1O-2+4NH+4+2H2O
B.偏铝酸钠溶液中加入过量盐酸 A1O2-+4H+
A13++2H2O
C.碳酸氢铵溶液中加入过量NaOH溶液
HCO3-+OH- CO32-+H2O
D.硫酸亚铁溶液中加过氧化氢溶液
Fe2++4H2O2+H+ Fe3++4H2O
8.由短周期两种元素形成化合物A2B3,A3+比B2-少一个电子层,且A3+具有与Ne相同的核
外电子层结构,则下列说法不正确的是 ( ) A.元素A与B处于同一周期
B.A3+与B2-最外电子层上的电子数相等
C.B是3周期第ⅥA族的元素
D.A2B3是A12O3
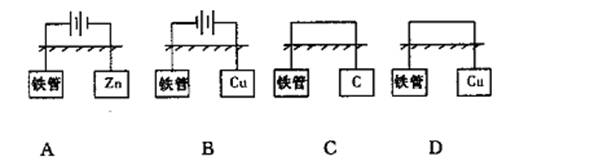
9.如下图所示方法中,能保护地下铁管不被腐蚀的是 ( )
|
10.下列叙述中可以说明金属甲的活动性比金属乙强的是 ( )
A.在氧化还原反应中,甲原子比乙原子失去的电子数多
B.同价态的阳离子,甲比乙的氧化性强
C.甲能跟稀盐酸反应而乙不能跟盐酸反应
D.将甲、乙作电极组成原电池时甲是正极
11.在pH=2的某溶液中,存在大量的Na+,NH4+,Mg2+,Fe2+,Fe3+离子,则在该溶液中可以大量存在的阴离子是 ( )
A.C1- B.NO3- C.S2- D.SCN-
12.将0.1mol·L-1的H2S水溶液加水稀释为0.01mol·L-1时,下列各粒子的浓度减少最多的是 ( )
A.S2- B.H2S C.HS- D.H+
13.在10mL0.1mol·L-tNaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各粒子的浓度关系错误的是 ( )
A.c(Na+)=c(Ac-)+c(HAc)
B.c(Na+)+c(H+)=c(Ac-)+c(OH-)
C.c(Na+)>c(Ac-)>c(H+)>c(OH-)
D.c(Na+)>c(Ac-)> c(OH-)> c(H+)
14.在25℃时,某溶液由水电离出的氢离子的浓度为1×10-12mol/L,下列说法错误的是
( )
| |
B.该溶液的pH不可能2
C.向该溶液中加入铝片后,可能生成氢气
D.若该溶液中的溶质只有一种,则它可能是酸,或者是碱,或者是盐
15.有5.1g镁铝合金,投入500mL 3mol·L-1HCI溶液中,金属全部溶解后,再加入4mol·L-1NaOH溶液,若要求在到沉淀最大值,则加入NaOH溶液应为 ( )
A.250mL B.560mL C.375mL D.500mL
|
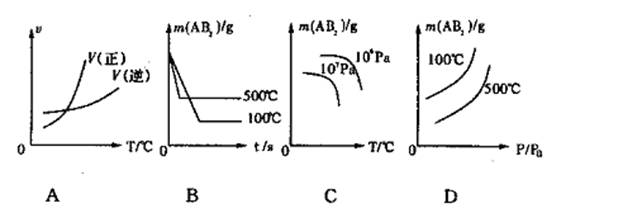
![]() 17.在恒温下的密闭容器中,有可逆反应2NO(g)+O2(g) 2NO2(g);△H<0不能说明已达到平衡状态的是 ( )
17.在恒温下的密闭容器中,有可逆反应2NO(g)+O2(g) 2NO2(g);△H<0不能说明已达到平衡状态的是 ( )
A.正反应生成NO2的速率和逆反应生成O2的速率相等
B.容器中压强不随时间变化而变化
C.气体混合物颜色深浅保持不变
D.混合气体平均相对分子质量保持不变
第Ⅱ卷(非选择题,共49分)
二、填空题(每空2分,共30分)
18.(8分)一定温度下的密闭容器内,充入2mol N2、6mol H2发生如下反应:
![]() N2+3H2 2NH3,达到平衡后,NH3的体积分数为a%。
N2+3H2 2NH3,达到平衡后,NH3的体积分数为a%。
(1)等温等容时,向该容器中再充入1mol N2、3mol H2,达到平衡时若NH3和体积分数为b%,则a b;若改为等温等压,则a b。(填“>”、“=”或“<”)
|
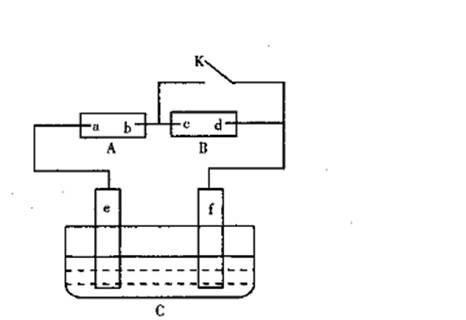
19.(14分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为 极
(2)滤纸B上发生的总化学方程式为:
| |
(4)若A中的总反应为:CH4+2O2+2KOH K2CO3+3H2O,
则a电极反应式为: ;
b电极反应式为: 。
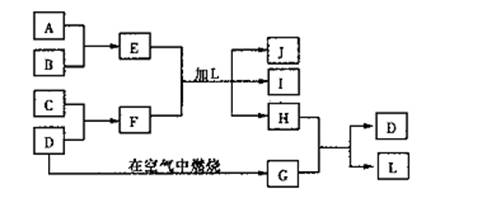
20.(8分)下图每一个方框中的字母代表一种反应物或生成物,已知A、B、C、D都是中学化学中常见的单质,且D是淡黄色固体单质。产物J是含A元素的胶状白色沉淀,I为NaC1溶液。度填写下列空白:
|
(1)L的化学式为 。
(2)实验室配制E的溶液时,应将固体E溶于 。
(3)E+F+L反应的离子方程式为 。
(4)H和H之间反应的化学方程式 。
三、实验题(12分)
21.(12分)草酸晶体的组成可表示为H2C2O4·nH2O,为测定n值,进行下述实验:
①称取Wg草酸晶体配成100.00mL水溶液;
②取25.00mL所配的草酸溶液置于锥形瓶中,加适量的稀H2SO4,用浓度为amol·L-1的KMnO4溶液滴定,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4
K2SO4+10CO2↑+8H2O+2 MnSO4,反应生成的MnSO4的水溶液无色,试回答下列问题:
(1)为保证实验的精确度,实验①中,应从下列仪器中选取的仪器是 。
a.托盘天平(含砝码、镊子) b.50mL酸式滴定管
c.100mL量筒 d.100mL容量瓶
e.烧杯 f.胶头滴管
g.锥形瓶 h.玻璃棒
i.药匙 j.50mL碱式滴定管
(2)实验②中,滴定时KMnO4酸性溶液应装在 式滴定管中。
(3)在滴定过程中,右手振荡锥形瓶,左手控制开关活塞,眼睛注视锥形瓶内溶液的颜色变化,达到终点的标志是 。(已知该反应中不使用指示剂,而用某种反应物自身颜色变化来指示终点。)
(4)若滴定过程中,共同去a mol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为 mol·L-1,则n= 。
(5)若滴定终点读数时俯视,则计算的n值可能会 (填“偏大”“偏小”或“无影响”)
四、计算题(7分)
22.(7分)标准状况下进行下列实验:甲、乙、丙各取30.0mL同浓度的盐酸,加入同一种镁铝合金,所取合金质量和产生气体的体积如表所列,求:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(mg) | 510 | 765 | 918 |
| 气体体积(mL) | 550 | 672 | 672 |
(1)盐酸的物质的量浓度= ;(2分)
(2)合金中Mg的质量分数= ;(2分)
(3)丙实验后,还需向容器中加入1.00mol/L的NaOH溶液 mL才能使剩余合金中的铝粉恰好完全溶解。(3分,此问要有计算过程,否则无分)
参考答案
一、选择题(每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | B | B | C | A | D | B | D | B | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |||
| 答案 | A | B | C | B | C | D | A |
二、填空题(每空2分,共30分)
18.(8分)
(1)< 1 =
(2)a+c/2=2, b=3c/2=6, a/b=1/3。
19.(14分)
|
(2)2NaC1+2H2O
2NaOH+H2↑+C12↑
(3)Zn-2e- Zn2+,Zn2++2e- Zn2+;含Zn2+的电解质溶液
(4)2O2+8e-+4H2O 8OH-
CH4-8e-+10OH-=CO32-+7H2O
20.(8分)
(1)H2O
(2)HC1(盐酸)
(3)2A13++3S2-+6H2O 2A1(OH)3↓+3H2S↑
(4)2H2S+SO2
3S+2H2O
三、实验题(12分)
21.(12分)
(1)a、d、e、f、h、i(全对计2全,少或多选1个扣1分)。
(2)酸
(3)滴最后1滴高锰酸钾溶液紫色不褪。
(4)0.1aV(100W/aV-90)/18或(50W/9aV-5)
(5)偏大
四、计算题(7分)
22.(7分)
(1)2.0mol/L
(2)47.1%
(3)78mL
[解析](1)∵乙或丙中H2为0.03mol,且盐酸已反应完全
![]()
(2)设Mg、A1分别为x、y摩尔中,甲中![]()
![]()
![]()
(3)丙中Mg、A1都为![]() mmol
mmol
根据题意由电荷守恒可得
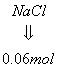
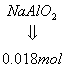
![]()
或:根据C1守恒:n(NaC1)=n(HC1)=2mol/L×0.03L=0.06mol
根据A1守恒:n(NaA1O2)=n(A1)=0.018mol
由Na守恒:n(NaOH)=n(NaC1)+n(NaA1O2)=0.06mol+0.018mol=0.078mol
V(NaOH)=![]()