高三化学第一次诊断性测试
(考试时间90分钟,总分100分)
可能用到的相对原子质量:H—1 O—16 Na—23 S—32 K—39
一、选择题(每小题只有一个选项符合题意,请将正确答案的序号填在括号内。每小题3分,共54分)
1.1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域做出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命性的变化。下列说法正确的是( )
A.化学不再是纯实验科学 B.化学不再需要实验
C.化学不做实验,就什么都不知道 D.未来化学的方向还是经验化
2.从硫元素的化合价态上判断,下列物质中的硫元素不能表现氧化性的是( )
A.Na2S B.S C. SO2 D.H2SO4
3.FeCl3溶液、Fe(OH)3胶体共同具备的性质是( )
A.加入饱和MgSO4溶液都发生聚沉
B.分散质的粒子都不能通过半透膜
C.都比较稳定,密封保存一段时间都不会产生沉淀
D.加入硫酸先产生沉淀,后沉淀溶解
4.下列各物质中,所有原子都满足最外层为8电子结构的是( )
A.Be Cl2 B.PCl3 C.PCl5 D.NH3
5.根据磷元素的原子结构示意图![]() ,作出如下推理,其中与事实不符的是( )
,作出如下推理,其中与事实不符的是( )
A.磷元素位于元素周期表的第三周期、第VA族
B.磷原子不如氮原子和硫原子的得电子能力强
C.磷单质不如氮气和硫单质活泼
D.磷的氢化物(PH3)受热时不如氮的氢化物(NH3)和硫的氢化物(H2S)稳定
6.最近我国某近代物理研究所取得重大科研成果,研制出首批氧—18气体(18O2),氧—18是一种稳定的氧的同位素,称为重氧。下列有关说法正确的是( )
A.1.8g氧-18气体(18O2)的物质的量是0.1mol
B.0.1mol重氧水H218O所含的中子数为6.02×1023
C.0.2mol氧—18气体(18O2)的体积约为4.48L
D.氧-18气体的摩尔质量是36g
7.下列离子反应方程式正确的是( )
A.铜和硫酸锌溶液:Cu+Zn2+====Cu2++Zn
B.澄清的石灰水中加入少量NaHCO3溶液:Ca2++2OH-+2![]() ====
CaCO3↓+2H2O+
====
CaCO3↓+2H2O+![]()
C.少量的盐酸逐滴滴入碳酸钠溶液:![]() +2H+==== CO2↑+H2O
+2H+==== CO2↑+H2O
D.溴化亚铁溶液中通入少量氯气:2 Fe2++ Cl2====2 Fe3++2Cl-
8.用惰性电极电解100mL浓度为0.05mol/L的CuSO4溶液,通电一段时间,Cu2+恰好反应完全,若溶液体积仍为100mL,此时溶液的pH为( )
A.1 B.2 C.12 D.13
9.在25℃时,将两个惰性电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,阴极上逸出amol气体,同时有wg Na2SO4·10 H2O晶体析出,若温度不变,则剩余溶液中溶质的质量分数为( )
A.![]() ×100%
B.
×100%
B.![]() ×100%
×100%
C. ![]() ×100%
D.
×100%
D.![]() ×100%
×100%
10.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )
A.滴加石蕊试液显红色的溶液:Fe3+、![]() 、Cl-、SCN-
、Cl-、SCN-
B.pH值为1的溶液:Cu2+、Na+、Al3+、![]()
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、![]() 、Br-、Ba2+
、Br-、Ba2+
D.所含溶质为Na2SO4的溶液:K+、![]() 、
、![]() 、Mg2+
、Mg2+
11.把Ba(OH)2溶液逐滴滴入明矾溶液中,使![]() 全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A.Al3+ B.Al(OH)3
C.AlO2或[Al(OH)4]- D.Al3+和AlC(OH)3
12.我国发射“神五”所用的“长征2号”火箭的主要燃料是偏二甲肼(C2H8N2),氧化剂是N2O4,燃烧的产物若只有N2、CO2和H2O。有的国家用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:N2(g)+2O2(g)====2NO2(g);ΔH=+67.7kJ·mo L-1,N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH=-534 kJ·mol-1
下列关于肼和NO2反应的热化学方程式中,正确的是( )
A.2N2H4(g)+2NO2(g)====3N2(g)+4H2O(1); ΔH=-1 135.7 kJ·mol-1
B.2 N2H4(g)+2NO2(g)====3N2(g)+4H2O(g);ΔH=+1135.7kJ·mol-1
C.N2H4(g)+NO2(g)====3/2N2(g)+2H2O(g);ΔH=-1135.7kJ·mol-1
D.2 N2H4(g)+2NO2(g)====3N2(g)+4H2O(g);ΔH=-1135.7 kJ·mol-1
13.下列物质中能够与酸反应生成盐和水,但不属于碱性氧化物的是( )
A.Na2O B. Na2O2 C.Na D.CuO
14.某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B![]() 2C,若维持温度和压强不变,当到达平衡时,容器的体积为VL,其中C气体的体积占10%,下列推断正确的是( )
2C,若维持温度和压强不变,当到达平衡时,容器的体积为VL,其中C气体的体积占10%,下列推断正确的是( )
①原混合气体体积为1.2VL;②原混合气体的体积为1.1VL;③反应达平衡时气体A消耗0.05VL;④反应达平衡时气体B消耗掉0.05VL。
A.②③ B.②④ C.①③ D.①②
15.某可逆反应:mA(气)+nB(气)![]() pC(气)(焓变为ΔH),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如下图所示,下列结论正确的是( )
pC(气)(焓变为ΔH),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如下图所示,下列结论正确的是( )
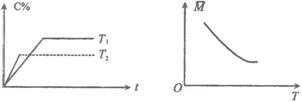
A.m+n>p ΔH>0 B.m+n>p ΔH<0
C.m+n<p ΔH>0 D.m+n<p Δ<0
16.在恒温恒容的密闭容器中放入一定量的NO2,发生反应2NO2(g)![]() N2O4(g);ΔH<0,达到平衡后,若分别单独改变下列条件,重新达到平衡后,能使该反应的平衡混合气体平均相对分子质量减小的是( )
N2O4(g);ΔH<0,达到平衡后,若分别单独改变下列条件,重新达到平衡后,能使该反应的平衡混合气体平均相对分子质量减小的是( )
A.降低温度 B.通入NO2 C通入N2O4 D.升高温度
17.1998年两位希腊化学家在《科学》杂志上发表论文,称他们在常压下把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池(如下图)中,氢气和氮气在电极上合成了氨气,且转化率达到了78%。用来合成的电解质在电解池中起传导H+的作用,它是一种固体复合氧化物(缩写为SCY),电解池的两个电极则是吸附在SCY内外表面上的金属钯多晶薄膜。下列说法中不正确的是( )
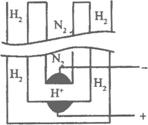
A.阳极的反应式为H2-2e-====2H+
B.阴极的反应式为 N2+6e-+6H+====2NH3
C.电解的总反应式
N2+3H2![]() 2NH3
2NH3
D.电解的总反应式
3H++N3-![]() NH3
NH3
18.蓄电池在放电时起原电池的作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别在充电和放电时发生的反应:
Fe+NiO2+2 H2O![]() Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
下列有关对爱迪生蓄电池的推断错误的是( )
A.放电时,Fe是负极,NiO2是正极
B.充电时,阴极上的电极反应式为Fe(OH)2+2e-====Fe+2OH-
C.放电时电解质溶液中的阴离子是向正极方向移动
D.蓄电池的电极必须浸入碱性电解质溶液中
二、非选择题(共46分)
19.(6分)有一质量为Wg,相对分子质量为b的某种碱M(OH)2,在一定温度下完全溶解为VmL的饱和溶液。若溶液的密度为dg/cm3,则溶液的物质的量浓度是________,溶质的质量分数是__________,该温度下的溶解度是__________。
20.(5分)根据氧化还原反应2 FeCl3+Fe====3FeCl2,设计一个原电池,用________作负极,电极反应为___________________________;电解质溶液是_____________________________;用____________作正极,电极反应为_______________________。
21.(3分)有两瓶pH=2的酸溶液,一瓶是强酸,一瓶是弱酸。现只有石蕊、酚酞试液、pH试纸和蒸馏水,而没有其他试剂。简述如何用最简便的实验方法来判别哪瓶是强酸。
________________________________________________________________________________________________________________________________________________________。
22.(10分)短周期的六种元素A、B、C、X、Y、Z,原子序数依次变小,其中X、Y、Z原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物;C与X处于同周期,B+与C2-的核外电子排布相同,A与B处于同周期,且形成BA型化合物。请回答:
(1)Y元素的名称是_____________________________________________________________:
(2)XZ3化合物的电子式是________________________________________________________;
(3)A、B、C的离子半径由大到小的顺序为________________________(用元素离子符号表示);
(4)化合物XZ4A中所含有的化学键类型为_______________________________________;
(5)元素组成为XZ5YC3和BCZ化合物反应的离子方程式为__________________________。
23.(10分)下图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2 molX、2 molY,起始时,VA=aL,VB=0.8aL(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)![]() 2Z(g)+2W(g),达到平衡时,VB=0.6aL。
2Z(g)+2W(g),达到平衡时,VB=0.6aL。
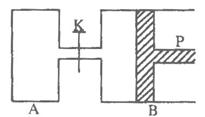
(1)B中X的转化率为_____________。
(2)A、B中X的转化率的关系是A_________B(填“>”“=”“<”),其理由是________________________________________________________________________。
(3)平衡时A、B中混合气体的平均相对分子质量的关系是:MA_________MB(填“>”“=”“<”)。
(4)如果要计算出平衡时B中混合气体的密度,则至少还需要知道的数据是___________(MX、MY、MZ、MW分别表示X、Y、Z、W的摩尔质量)。
①MX ②MY ③MZ ④MW
A.③和④ B①和② C.①和③ D.②③④
(5)打开K,一段时间后反应再次达到平衡,则B的体积为________L。
24.(12分)如下图所示:甲、乙为相互串联的两电解池。
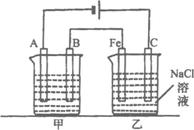
试回答:
(1)乙池中Fe极电极反应式为______________,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈_________色。
(2)甲池若为用电解原理精炼铜(假设粗铜的组成
是均匀的,且比其活泼和不活泼的成分均存在)
的装置,则A电极名称为__________极,电极反应式为______________,电解质溶液可以是______________;通电一段时间后,A极增重12.8 8,则甲池溶液原溶质的浓度(填“增大”减小”不变”或“无法确定”),乙池C(石墨)极放出气体在标况下的体积为____________,此时乙池剩余溶液的体积为400mL,则溶液的pH=__________。
第一次诊断性测试化学参考答案
一、选择题(每小题只有一个选项符合题意,请将正确答案的序号填在括号内。每小题3分,共54分)
1. A
解析:考查考生分析信息、加工信息能力,B、C、D.明显错误只有A能从题干看出符合题意。
2. A
解析:S元素的化合价有-2价,0价,+4价,+6价,元素处在最低价只有还原性,没有氧化性,Na2S中S为-2价,处于最低价。
3. C
解析:溶液和胶体共同特征是都比较稳定、密封一段时间都不会产生沉淀,溶液可透过半透膜,而胶体粒子不能透过半透膜。
4. B
解析:BeCl2中Be原子,PCl5中P原子,NH3中H原子分别满足4电子、10电子、2电子的结构,而非8电子的结构。
5. C
解析:P单质比N2要活泼,因为N2分子中存在“N≡N”,键能很大,拆开“N≡N”键需要的能量非常多,故N2很稳定。
6. B
解析:A:n=![]() =0.05mol故A错。B:1molH218O中子数为(18-8)=10mol
=0.05mol故A错。B:1molH218O中子数为(18-8)=10mol
0.1molH218O中子数为l0×0.1=1mol故B对
C:没有提到“是否处在标准状况下”,不能算体积
D:摩尔质量单位是“g/mol”
7. D
解析:A是不反应的;B的正确形式应该是:Ca2++OH-+![]() =CaCO3↓+H2O;C的正确形式是:H++
=CaCO3↓+H2O;C的正确形式是:H++![]() =
=![]() ;D中由于C12少量。故FeBr2中只有Fe2+被氧化,Br没有被氧化。
;D中由于C12少量。故FeBr2中只有Fe2+被氧化,Br没有被氧化。
8. A
解析:电解CuSO4的总反应是:
2CuSO4+2H2O![]() 2Cu+O2+2
H2SO4
2Cu+O2+2
H2SO4
0.05mol×0.1L 0.05mol/L×0.1L=0.005mol
[H+]=![]() =0.1mol/L
=0.1mol/L
∴pH=![]() =lg0.1=1
=lg0.1=1
9. D
解析:电解Na2SO4溶液实质就是电解水,阴极析出a mol气体,则根据:
2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
36 g 4 g 32 g
x 2ag x=18a g
有18ag水发生电解,则析出WgNaSO4·10H2O。
溶质Na2SO4的质量=![]() ·w
·w
溶液的总质量=W+18a
∴Na2SO4%= ×100%=
×100%=![]() ×100%
×100%
10. B
解析:A中Fe3+与SCN-不共存;C中“水电离出来的c(H+)=10-13mol/L的溶液可能为酸,可能为碱,而无论在酸中还是碱中![]() 都不可共存,D中Mg2+与
都不可共存,D中Mg2+与![]() 不共存。
不共存。
11. C
解析:反应的化学方程式为2 Ba(OH)2+KAl(SO4)2====2BaSO4↓+KAlO2+2H2O
(要想![]() 完全沉淀,二者摩尔比应为2:1)
完全沉淀,二者摩尔比应为2:1)
12. D
解析:将第一个方程式的逆反应写出来;然后将第二个方程式两边系数扩大2倍,然后把两个方程式叠加起来,就得到答案D。
13. B
解析:A和D是碱性氧化物,Na与酸反应生成盐和H2,Na2O2与酸反应可以生成盐和O2,
Na2O2+2HCl=2NaCl+H2O
+![]() O2
O2
14. A
解析:A+ 3B![]() 2C
2C
始 0
转 0.05V 0.15V 0.1V
平 0.1V
从左式可看出反应物消耗了0.05V+0.15V=0.2V,生成物增加了0.1V,所以反应前后总体积应减少了0.2V-0.1V=0.1V
∴反应前体积V+0.1V=1.1V
15. B
解析:先看左图,根据“先拐先平衡”“先拐温度高”原则。T2比T1先平衡,故T2>T1。再做一竖直辅助线,可看出T升高,C降低说明平衡左移了,即升温平衡左移,说明逆向为吸热反应,从而正向为放热反应,再看右图,T升高,![]() 降低说明n升高而T升高平衡应逆向移动说明逆向为物质的量增大的方向,故m+n>p。
降低说明n升高而T升高平衡应逆向移动说明逆向为物质的量增大的方向,故m+n>p。
16. D
解析:![]() 要减小,则n一定增大,则平衡定逆向移动。A、B都使平衡正向移动,C通入N2O4,m升高,n升高,
要减小,则n一定增大,则平衡定逆向移动。A、B都使平衡正向移动,C通入N2O4,m升高,n升高,![]() 不一定降低。
不一定降低。
17. D
解析:H2为电解池的阳极,N2为电解池的阴极,阳极发生失电子的氧化反应,阴极发生得电子的还原反应。
18. C
解析:放电时是原电池,充电时是电解池。在原电池中电解质的阳离子是向正极移动的,故C错,蓄电池的电极都是碱性物质,故电解质溶液也得是碱性的,否则会破坏电极,故D对,原电池的负极连接电解池的阴极,故A、B均正确。
二、非选择题(共46分)
19.(2分×3=6分)
![]() mol/L
mol/L
![]()
![]()
解析:此题考查考生的化学计算能力和运用字母计算的抽象思维能力
n=![]()
C=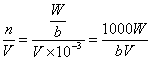 (mol/L)
(mol/L)
a%=![]()
S=![]()
20.(1分×5=5分)
铁 Fe-2e-=Fe2+ FeCl3溶液 惰性电极
Fe3++e-=Fe2+
解析:此题考查运用氧化还原反应设计原电池的知识,要求考生了解原电池的构造,负极是发生失电子的氧化反应,故负极应为Fe,反应为Fe-2e-=Fe2+;正极是发生得电子的还原反应。故Fe3++e-=Fe2+。
21.各取等体积酸液用蒸馏水稀释相同倍数(如100倍),然后用pH试纸分别测其pH值,pH值变化大的是强酸。(3分)
解析:此题考查强弱电解质的概念,pH=2的强酸稀释100倍,pH应为4;而pH=2的弱酸稀释100倍,由于在稀释的过程中还可以继续电离出H+,故pH值变化小,应在2<pH<4之间。
22. (10分)(1)碳(2分)
![]()
(3)Cl->O2-> Na+ (2分)
(4)离子键和共价键(2分)
(5) ![]() +
+![]() +2OH-==== NH3·H2O +
+2OH-==== NH3·H2O +![]() +H2O (2分)
+H2O (2分)
解析:此题是元素周期律知识与元素化合物知识相结合考查考生的分析、判断、联想类推能力,A、B、C、X、Y、Z六种元素依次是Cl、Na、O、N、C、H。本题中要注意化学用语的表达一定要规范、准确,第(5)问要注意NH4HCO3中不仅阳离子![]() 要与碱反应,阴离子
要与碱反应,阴离子![]() 也要与碱反应,故要消耗2molNaOH。
也要与碱反应,故要消耗2molNaOH。
23.(10分) (2分×5=10分)
(1)75% (2)A<B B中压强比A中要大,而增大压强,有利于平衡向正反应方向移动,反应物的转化率增大。
(3)MA<MB (4)A或B (5)0.2aL
解析:此题考查的内容是化学平衡及平衡移动原理,需要考生有一定的抽象思维能力和推理能力。设B中的X消耗了m(mol)
3X+3Y![]() 2Z+2W
2Z+2W
始 2 2 0 0
转m m ![]()
![]()
平2-m 2-m
![]()
![]()
n始=2+2=4(mol)
n平=2-m+2-m+![]() +
+![]() =4-
=4-![]() (mol)
(mol)
∵恒温恒压下,![]()
∴![]() ∴
∴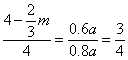
解出m=1.5(mol)
∴B中X的转化率=![]() ×100%=
×100%=![]() ×100%=75%
×100%=75%
第三问中![]() 因为B中压强大于A中压强,压强增大有利于平衡正向移动,从而n总减小,故
因为B中压强大于A中压强,压强增大有利于平衡正向移动,从而n总减小,故![]() 会增大,即
会增大,即
![]() ,
,![]()
∵mA=mB nA>nB ∴![]()
第四问实际考查的是质量守恒定律,ρB=![]() =2mol,ny=2mol,VB=0.6aL,
=2mol,ny=2mol,VB=0.6aL,
如果已知了Mx和My则可求出密度,而根据质量守恒定律,反应物的总质量等于生成物的总质量,2molX和2molY可完全转化为![]() molZ和
molZ和![]() molW,ρB=
molW,ρB=![]() ,
,
nZ=nW=![]() mol,VB=0.6aL,故如知道MZ和MW也可求出ρB。
mol,VB=0.6aL,故如知道MZ和MW也可求出ρB。
24.(12分)
(1)2H++2e-====H2↑(2分) 红(1分)
(2)阴(1分) Cu2++2e-====Cu(2分)
CuSO4溶液或CuCl2溶液(1分) 不变(1分)
4.48L(2分) 14(2分)
解析:本题考查电解原理及其应用(粗铜的精炼和电解饱和食盐水)。
乙池中Fe为阴极,溶液中H+放电形成H2放出,溶液中[OH-]提高,故显碱性,滴入酚酞变红。
甲池若为电解原理精炼Cu装置,则A极为精Cu,B极为粗Cu,阴极反应:Cu2+2e-=Cu,阳极反应:Cu-2e-=Cu由于阴极析出Cu的质量等于阳极溶解Cu的质量,故电解液浓度保持不变。
甲池中:
A极:Cu2++2e-====Cu
2 mol 64 g
x 12.8 g x=0.4 mol
乙池中:
2NaCl+2H2O![]() 2NaOH+H2↑+Cl↑—2e-
2NaOH+H2↑+Cl↑—2e-
2 mol 22.4L 2 mol
Z Y 0.4 mol
Y=4.48 L Z=0.4 mol
∴c(OH-)=![]() =1mol/L
=1mol/L
∴pH=![]() =14
=14