高三化学第一次诊断性考试能力测试
1、科学家发现了一种新的氧微粒O4,关于O4的下列说法中正确的是
A.它是氧的一种新的同位素
B.它是氧的一种新的同素异形体
C.它的摩尔质量为64
D.它的氧化性比O3弱
2、冰的晶体中,分子间存在的最强作用力是
A.离子键
B.共价键
C.氢键
D.范德瓦耳斯力
3、设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.9g重水(D2O)含有的电子数为5NA
B.28gCO和C2H4的混合物含有的分子数为NA
C.标准状况下,22.4L甲烷所含原子数为4NA
D.6g金刚石所含碳碳键数为2NA
4、X、Y两种短周期元素组成的化合物中原子数之比为1:3,则下列哪一组数值中,两个都不可能是X与Y的原子序数差值?
A.1和3
B.2和4
C.5和8
D.6和12
5、室温下,由水电离出的c(OH—)=1×10-13mol几的溶液中,一定能够大量共存的离子组是
A.K+、A13+、HCO3-、SO42-
B.Na+、I-、SO32-、NO3-
C.NH4+、Fe2+、CIO-、C1-
D.K+、Na+、SO42-、NO3-
6、常温下,Ca(OH)2的溶解度为0.185g,饱和石灰水的密度为lg·cm-3。将50mL饱和石灰水用蒸馏水稀释至250mL,所得溶液的pH为
A.2
B.11
C.11.7
D.12
7、将pH=2的醋酸和Ph=12的NaOH溶液等体积混合,所得溶液中离子浓度关系正确的是
A.c(CH3COO—)>c(Na+)>c(H+)>c(OH—)
B.c(Na+)>c(CH3COO—)>c(H+)>c(OH—)
C.c(CH3COO—)>c(Na+)>c(OH—)>c(H+)
D.c(Na+)>c(CH3COO—)>c(OH—)>c(H+)
8、一定条件下,在某密闭容器中充入N2和H2,反应N2+3H2![]() 2NH3;△H<0达到平衡。改变一个条件x,下列y的变化一定符合图中曲线的是
2NH3;△H<0达到平衡。改变一个条件x,下列y的变化一定符合图中曲线的是
| 选项 | X | Y |
| A | 压强 | H2转化率 |
| B | 压强 | NH3的体积分数 |
| C | 温度 | NH3的体积分数 |
| D | 温度 | N2的体积百分含量 |

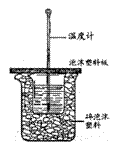 9、用右图所示装置进行中和热测定实验,请回答下列问题:
9、用右图所示装置进行中和热测定实验,请回答下列问题:
(1)大小烧杯之间填满碎泡沫塑料的作用是
,从实验装置上看,图中缺少的一种玻璃仪器是
。
(2)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的 比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H= ,H2SO4与NaOH反应的热化学方程式为
。
(3)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
(填“相等”、“不相等”),所求中和热 (填“相等”、“不相等”);,若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 (填“偏大”、“偏小”、“不受影响”)。
10、A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素;A、B,C三种元素的原子序数之和为31;D元素与A、B、C三种元素处于不同周期。请填空:
(1)C元素的名称 ,A、D两种元素形成的离子电子式为
。
(2)A、B、C、D四种元素组成的正盐的水溶液显酸性,用离子方程式表示其原因:
(3)BD3与BA2的反应常用于某工业尾气的处理,该反应的化学方程式为
。
(4)D2C和D2A2溶液反应生成了C的单质,该反应的化学方程式为
。
11、在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:2A(g)+B(g)![]() C(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD。
C(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD。
请填写下列空白:
(1)从反应开始至达到平衡,用D表示的平均反应速率为
。
(2)B的平衡浓度为
,A的转化率为
。
(3)在温度不变时,如果缩小容器体积,平衡体系中混合气体的密度
、平均相对分子质量
。(两空均填“增大”、“减少”或“不变”)
(4)如果上述反应在相同条件下从逆反应开始进行,最初加C和D各2mol,要使平衡时各物质的体积分数与原平衡相等,则还应加入
mol B物质。
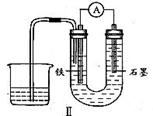
12、用下图I所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。
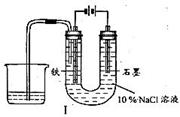
(1)用装置1电解食盐水时,总反应的离子方程式为
,为什么石墨电极上方得到气体的体积比铁电极上方得到气体的体积小得多?
。如果所用食盐水中含有MgCl2杂质,在电解过程中还可以观察到的现象是 。
(2)用装置Ⅱ进行实验时,有关电极反应式为:铁电极
,石墨电极
。
参考答案
1、B
2、C 3、B 4、A 5、D 6、D
7、A 8、C
9、(1)保温、隔热、减少实验过程中的热量损失;环形玻璃搅拌棒
(2)-56.8kJ•mol-1
H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l);ΔH=-113.6kJ•mol-1
(3)不相等;相等;偏小
10、(1)硫 ![]()
(2)NH4++H2O![]() NH3•H2O+H+
NH3•H2O+H+
(3)8NH3+6NO2=7N2+12H2O
(4)H2S+H2O2=S+2H2O
11、(1)0.2 mol/(L•min)
(2)0.8 mol/(L•min);40%
(3)增大 增大
(4)1
12、(1)2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
铁电极上生成的H2不溶于水,面石墨电极上生成相同体积的Cl2大部分溶解于水并与水反应 U形官左端的溶液变浑浊
(2)Fe-2e-+2OH-=Fe(OH)2↓,Cl2+2e-=2Cl-或HClO+H++2e-=Cl-+H2O