高三化学第一次诊断考试试题
理科综合(化学试题)
6.已知可逆反应2E(s)+F(g) = 2G(g);△H<0。下列反应条件有利于提高G的产率的是
A.低温、低压 B.低温、高压 C.高温、低压 D.高温、高压
答案A
7.甲酸和乙酸都是弱酸,当它们的浓度均为0.10mol/L时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为:a、乙酸、b,由此可知
A.a的浓度必小于乙酸的浓度 B.a的浓度必大于乙酸的浓度
C.b的浓度必小于乙酸的浓度 D.b的浓度必大于乙酸的浓度
答案A
8.下列反应的离子方程式书写正确的是
A.硫酸铝溶液中加入过量氨水:Al3++4NH3·H2O=![]() +4NH4++2H2O
+4NH4++2H2O
B.苯酚钠溶液中通入少量的二氧化碳气体:C6H5O-+CO2+H2O→C6H5—OH+![]()
C.澄清石灰水与少量苏打溶液混合:Ca2++![]() +
+![]() =CaCO3↓+H2O
=CaCO3↓+H2O
D.实验室用浓盐酸与二氧化锰反应制氯气:MnO2+2H++2![]()
![]() Mn2++C12↑+H2O
Mn2++C12↑+H2O
答案B
9.设NA为阿伏加德罗常数,下列说法正确的是
A.标准状况下,11.2LSO3所含的分子数为0.5NA
B.5.6g铁与足量盐酸反应转移的电子数为0.3NA
C.46gNO2和N2O4的混合物中含有的分子数为NA
D.常温常压下,17g氨气所含电子数为10NA
答案D
10.有反应![]() +
+![]() +H+ → R3++S↓+H2O,其中氧化剂与还原剂的物质的量之比为1︰3,则
+H+ → R3++S↓+H2O,其中氧化剂与还原剂的物质的量之比为1︰3,则![]() 中R的化合价为
中R的化合价为
A.+2 B.+4 C.+6 D.+7
答案C
11.下列化学用语正确的是
A.乙烯的结构简式为CH2CH2
B.羟基的电子式为[ ![]() ]-
]-
C.明矾的化学式为KAlSO4·12H2O D.乙酸分子的最简式为CH2O
答案D
12.用惰性电极实现电解,下列说法正确的是
A.电解稀盐酸溶液,实质是电解水,故溶液的pH变小
B.电解稀氢氧化钠溶液,要消耗![]() ,故溶液的pH变小
,故溶液的pH变小
C.电解稀硫酸钠溶液,在阴极和阳极上析出产物的物质的量之比为l︰2
D.电解氯化钠溶液,其在阳极附近的溶液中滴入KI溶液,溶液呈棕色
答案D
13.某羧酸的衍生物E的分子式为C6H12O2,已知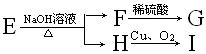 ,又知G、I都不能发生银镜反应,则E的结构可能有
,又知G、I都不能发生银镜反应,则E的结构可能有
A.1种 B.2种 C.3种 D.4种
答案B
26.(18分)已知SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;氧化铜和氧化铁是碱性氧化物,化学性质相似。三个研究性学习小组分别根据不同的微型课题进行研究,其方案如下:
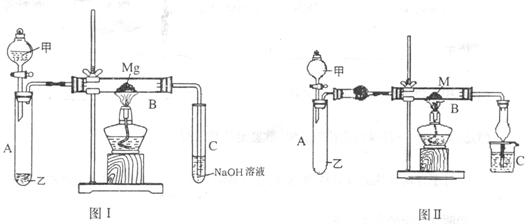
I、第一个研究性学习小组用如图(I)所示的装置进行镁与二氧化硫反应的实验。
(1)实验室制取二氧化硫类似于制取二氧化碳,在下列物质中选择最恰当的试剂制取二氧化硫:
A.10%的硫酸 B.80%的硫酸 C.浓盐酸 D.稀硝酸 E.亚硫酸钠固体 F.亚硫酸钙固体G.饱和亚硫酸钠溶液
(2)反应后,发现B管内壁有淡黄色固体粉末产生,取反应后B中固体溶于稀盐酸中,产生具有臭鸡蛋气味的气体,写出B管中发生的有关化学反应方程式
II、第二个研究性学习小组利用I装置(图I)进行适当改进(图II)来探究氨气的还原性。
(3)分别注明甲、乙两仪器中所用试剂:甲 乙: ,M为氧化铜。确认反应已发生的实验现象为:
Ⅲ、第三个研究性学习小组认为第Ⅱ组实验装置(图Ⅱ)再补充加热装置就可以验证乙醇在加热条件下能否被氧化铁氧化。
(4)补充加热装置的位置是(用字母表示) ;M为氧化铁,C中为银氨溶液,确认反应发生的现象是 ,B中发生反应的化学方程式是: 。
答案:I、(1)C F。(2)5Mg+2SO2
= 4MgO+S+MgS 。II、(3)甲:浓NH3水,乙:CaO,B管中氧化铜变红色物质。III、(4)A、C;C中有银镜出现,CH3CH2OH+CuO ![]() CH3CHO+H2O+Cu
CH3CHO+H2O+Cu
27.(14分)周期表前20号元素中有A、B、C、D、E五种元素。已知它们都不是稀有气体元素,且原子半径依次减小,其中A、E同族,A与C、B与E原子的电子层数都相差2,A、B原子的最外层电子数之比为1︰4,A和C能以原子个数比1︰l形成一种化合物。
(1)写出元素符号:B ,C ,E 。
(2)由A、B、C、E四种元素中两种所形成的化合物中
①属于离子化合物且能与水反应产生氢气,则其与水反应的方程式为: 。
②所形成的晶体为分子晶体的是(写化学式,下同) (只填一种)
③所形成的晶体属于原子晶体的是 SiO2 ,晶体中所含有的化学键间的键角有 种。
答案:(1)Si ,O,H。(2)①KH+H2O = KOH+H2↑ ②SiH4 。③SiO2,两种。
28.(12分)A—N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料。单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系。
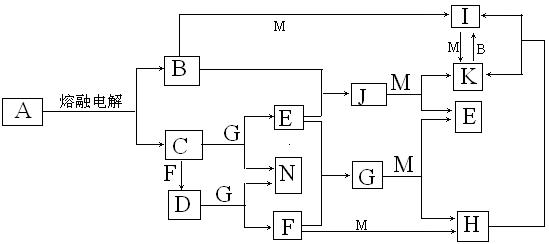
回答下列问题:
(1)D的电子式为
(2)G和M反应的方程式为
(3)H和J反应的离子方程式为
(4)I可用于净化水,其原因是
答案:(1)![]() 。(2)3Fe + 4H2O
。(2)3Fe + 4H2O![]() Fe3O4+4H2↑。(3)Fe3O4+8H+
=Fe2++2Fe3++4H2O. (4)FeCl3电离生成Fe3+,Fe3+水解生成Fe(OH)3胶体具有吸附性。
Fe3O4+4H2↑。(3)Fe3O4+8H+
=Fe2++2Fe3++4H2O. (4)FeCl3电离生成Fe3+,Fe3+水解生成Fe(OH)3胶体具有吸附性。
29.(16分)某有机化合物A的结构简式如下:
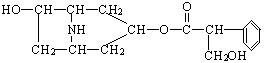
(1)A在NaOH水溶液中加热得到B和C,C是芳香化合物。B和C的结构简式是:B: ,C: ,该反应属于 反应。
(2)写出B与足量的冰醋酸发生酯化反应的化学方程式:
(3)室温下,C用稀盐酸酸化得到E,在下列物质中,不能与E发生化学反应的是 (填写序号);
①浓硫酸和浓硝酸的混合液体; ②CH3CH2OH(酸催化);③CH3CH2CH2CH3;④Na; ⑤CH3COOH(酸催化)
(4)写出同时符合下列两项要求的E的所有同分异构体的结构简式。
①化合物是1,3,5——三取代苯; ②苯环上的三个取代基分别为甲基、羟基和含有![]() 结构的基团。
结构的基团。
答案:(1)B: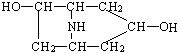 ,C:
,C: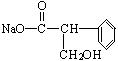 ,取代反应。
,取代反应。
(2)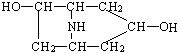 +2CH3COOH
+2CH3COOH![]()
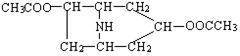 +2H2O
+2H2O
(3)③
(4)4种,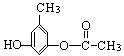 、
、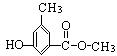 、
、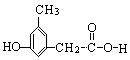 、
、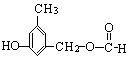 。
。