高三化学模拟质检练习
班级: 姓名: 分数:
一、选择(共48分)
1、下列说法正确的是 ( )
A、加碘食盐是在食盐中加入了碘单质。
B、市场上出现了各种各样的营养食盐,如:锌营养盐、钙营养盐 、硒营养盐、低钠营养盐、加碘食盐等十多种营养、保健盐;钙营养盐是在食盐中加入了氯化钙或碳酸钙等含钙的化合物
C、CO气体有毒,在生有炉火的居室中多放几盆水,可吸收CO。
D、绿色食品是指未使用过化肥和农药生产出来的农副产品
2、阿伏加德罗常数(NA)约为6.02×1023。下列叙述中不正确的是 ( )
A、标准状况下,22.4 L CO2和CO混合气体中含有的碳原子数约为6.02×1023
B、常温常压下,0.1 mol Fe在0.1 mol C12中充分燃烧,转移的电子数约为l.806×1023
C、31g白磷含有1.5NA个共价键
D、1 L l mol·L-1的NaHC03溶液中离子总数大于1.204×1024
3、正确掌握好化学用语是学好化学的基础,下列有关表述正确的是 ( )
A.CO2的分子模型:![]()
B. NH3的结构式:![]()
C.NH4Cl的电子式为: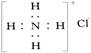
D.F原子结构示意图:![]()
4.国际化学组织已将周期表中原主、副族的族号去掉而改称列,如碱金属为第1列,稀有气体为第18列。按此规定,下列叙述中正确的是 ( )
A、第15列元素形成的RH3型化合物中自上至下熔沸点依次升高 。
B、第14列元素所形成的化合物种类最多
C、第17列元素均有最高价氧化物R 2 O7 ,
D、最外层有2个电子的原子都在第2列
5.室温下,强酸性和强碱性溶液中都能大量共存的离子组是 ( )
A、NH4+、Fe2+、Cl-、NO3- B、K+、Na+、SO32-、CO32—
C、K+、Na+、AlO2-、SO42- D、.Ba2+、Na+、NO3-、Cl-
6、能正确表示下列反应的离子方程式的是 ( )
A.小苏打溶液与醋酸反应:HCO3-+H +=====CO2↑+H2O
|
B.用铜作电极电解硫酸铜溶液:2Cu2++2H2O=====4H++2Cu+O2↑
C.饱和碳酸氢钙中加入过量的澄清石灰水:Ca2++HCO3-+OH-===CaCO3↓+H2O
D.硫化亚铁与稀硝酸反应:FeS + 2H + ===Fe2+ +H2S↑
7、对可逆反应4A(g)+5B(g)≒ 4C(g)+6D(g)△H<0,下列叙述中正确的是( )
A、化学反应速率关系是:3v正(A)=2v正(D)时达到平衡;
B、若单位时间内生成x mol C的同时,消耗x mol A,则反应一定处于平衡状态
C、达到化学平衡后,增大容器的容积,则正反应速率减小,逆反应速率增大
D、达到化学平衡后,升高温度,则C的质量分数减小
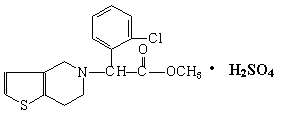 8、波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音。波立维属于硫酸氢盐,它的结构如图所示。下列关于它的说法正确的是
8、波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音。波立维属于硫酸氢盐,它的结构如图所示。下列关于它的说法正确的是
A.该物质的化学式为C16H15ClNO2·H2SO4 B.该物质不溶于水
C.波立维能和氢气反应,每摩最多可消耗3摩氢气
D.它可以与NaOH溶液反应,1mol该物质最多可消耗4molNaOH
二、填空题:60分。
9、(1)(6分)下列有关实验的叙述,正确的是(填序号)(少一个扣一分,多一个倒扣一分,扣完为止) 。
(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)用渗析法分离淀粉溶液中混有的NaCl杂质
(C)无法用分液漏斗将甘油和水的混合液体分离
(D).在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
(E)为了测定某溶液的pH,将经水润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓硝酸洗涤做过银镜反应的试管
(G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(H) 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(J)在氢氧化铁胶体中加少量硫酸会产生沉淀
(2)、(3分)有以下七种饱和溶液:①Ba(NO3)2;②Ca(OH)2;③Ca(ClO)2:④CaCl2;⑤Na2CO3;⑥NaAlO2;⑦NH3和NaC1,分别持续通入CO2,最终能得到沉淀或析出晶体的是
(3)、(9分)混合物平均摩尔质量通常可表示为:![]() ,利用此概念可以讨论许多化学问题:
,利用此概念可以讨论许多化学问题:
①相同条件下,潮湿空气的密度 (选填“>”、“<”或“=”)干燥空气的密度,理由是: ;
②在一定条件下的密闭容器中,存在如下平衡:C(s)+H2O(g)![]() CO(g)+H2 (g);假如温度保持不变并加压,则
CO(g)+H2 (g);假如温度保持不变并加压,则![]() (混合气)将
(填写“变大”、“变小”或“不变”);
(混合气)将
(填写“变大”、“变小”或“不变”);
③以物质的量之比为1:2相混合的Na2SO3和K2SO3的混合物共a g,与足量盐酸反应生成的SO2物质的量n(SO2)= mol(用含a的代数式表示)。
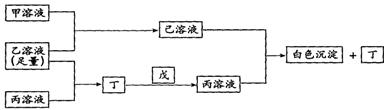 |
10、(14分)有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:
请回答:
(1)写出C元素的原子结构示意图__________,写出丁和戊的电子式________、_______;
(2)用有关化学用语解释:乙溶液呈酸性的原因________________________ ______;
丙溶液呈碱性的原因__________________________ ___;
(3)写出有关反应的离子方程式:
①乙溶液+丙溶液→丁______ __________________ ______;
②己溶液+丙溶液→丁_________ ___________________ __
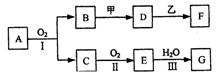 11、.(15分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
11、.(15分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
(1)若A为黄色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则 ①工业上反应I在 中进行,反应Ⅲ在 (均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是 或 。
③反应I的化学方程式是 。
(1) 若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①甲的电子式是 。
②D的溶液与乙反应的离子方程式是 。 ③若1.7gA与O2反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:
12、(13分)解热镇痛药非那西汀的合成路线:
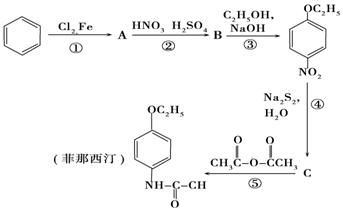
根据该合成路线,回答下面问题
(1)写出A、B、C的结构简式___________________________________________;
(2)写出反应⑤的化学方程式____________________________________________。
(3)请推测与化合物C是同分异构体,且苯环上只有2个取代基,并含有酚羟基和-NH2的
化合物有 种。
参考答案
1、D 2、B 3、4、B 5、D 6、C 7、D 8、D
9、(1)BCDGJ (2)、⒌⒍⒎ (3)、①②③