高三化学流程图题型专项训练十一(化学)
1.某试剂厂有银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银.步骤如下:
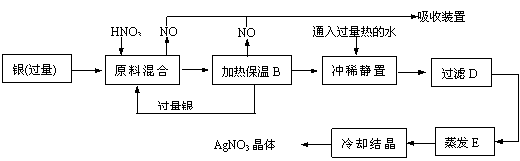
依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用 硝酸(填浓或稀)。原因是 (填序号,下同)
(a)减少过程中产生NOX的量 (b)减少原料银的消耗量 (c)节省硝酸物质的量
(2)步骤B加热保温的作用是 .
(a)有利于加快反应速率
(b)有利于未反应的硝酸挥发
(c)有利于硝酸充分反应,降低溶液中[H+]
(3)步骤C中是为了除去Fe3+、Cu2+等杂质,冲稀静置时发生的化学反应是
(a)置换反应 (b)水解反应 (c)氧化还原反应
 产生的沉淀物化学式
.
产生的沉淀物化学式
.
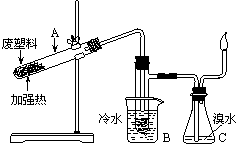
2.某些废旧塑料可采用下列方法处理:
将废塑料隔绝空气加强热,使其变成有用
的物质。实验装置如右图:加热聚丙烯废
塑料得到的产物如下表:
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
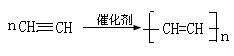
⑴ 试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
写出反应②、③的化学方程式______________________、____________________。
⑵B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有_______种。
⑶ 锥形瓶C中观察到的现象______________________。经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为_______________。
⑷ 写出C中逸出的气体在工业上的两种用途______________________________、_________________________________________________。
3.纤维素是自然界最为丰富的可再生的天然高分子资源。
(1)纤维素可制备用于纺织、造纸等的粘胶纤维[成分是(C6H10O5)n],生产过程涉及多个化学反应。工艺简图如下:

近来,化学家开发了一种使用NMMO加工纤维素的新方法,产品“Lyocell纤维”成分也是C6H10O5)n。工艺流程示意图如下:
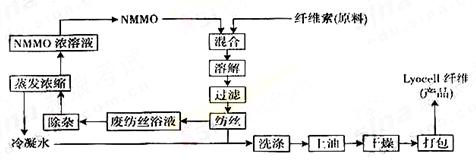
①“Lyocell纤维”工艺流程中,可充分循环利用的物质是 。
②与“Lyocell纤维”工艺相比,粘胶纤维工艺中会产生含有 (只填非金属元素符号)的废物,并由此增加了生产成本。
③“Lyocell纤维”被誉为“21世纪的绿色纤维”,原因是 。
(2)“Lyocell纤维”工艺流程中的NMMO可按如下路线制备(反应条件均省略):
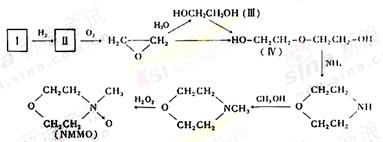
其中,化合物Ⅰ可三聚为最简单的芳香烃,化合物Ⅱ可使溴水褪色。
①化合物Ⅰ也可聚合为在一定条件下具有导电性的高分子化合物,该高分子化合物的化学式为 。
②化合物Ⅱ与氧气反应的原子利用率达100%,其化学方程式为
。
③关于化合物Ⅲ、Ⅳ的说法正确的是 (填代号)。
A.都可发生酯化反应 B.Ⅲ可被氧化,Ⅳ不可被氧化 C.都溶于水 D.Ⅲ可与钠反应,Ⅳ不可与钠反应 E.Ⅲ是乙醇的同系物 F.Ⅲ可由卤代烃的取代反应制备
4.钨是我国丰产元素 , 是熔点最高的金属 , 广泛用于拉制灯泡的灯丝 , 有“光明使者”的美誉。钨在自然界主要以钨 (+6价) 酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。 白钨矿的主要成分是钨酸钙 (CaW04); 黑钨矿的主要成分是铁和锰的钨酸盐 , 化学式常写成(Fe,Mn)W04。黑钨矿传统冶炼工艺的第一阶段是碱熔法 :
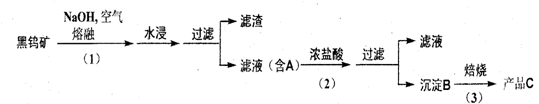
其中 A 、 B 、 C 都是钨的化合物。
(1) 写出上述流程中 A 、 B 、 c 的化学式。
A_________________ B_________________ C__________________
(2) 钨冶炼工艺的第二二阶段则是用碳、氢等还原剂把氧化钨还原为金属钨。对钨的纯度要求不高时 , 可用碳作还原剂。写出用碳还原氧化钨制取金属钨的化学方程__________________________________________________________________
为了获得可以拉制灯丝的高纯度金制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂 ,为什么 ?____________________________________________________
(3)仲钨酸的阱盐在热分解时会发生内在氧化还原反应 ,我国钨化学研究的奠基人顾冀东先生采用这一反应制得了监色的、非整比的钨氧化物 WO3-x。 这种监色氧化钨具有比表面大、易还原的优点 , 在制钨粉时温度容易控制 ,目前冶炼拉制钨丝的金属钨都用蓝色氧化钨为原料。经分析 , 得知蓝色氧化钨中钨的质量分数为 0.7985。
①计算 W03-x中的x值。X=__________________
②一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价两种价态的钨。则蓝色氧化钨中这两种价态的钨原子数比。___________:___________
( 相对原子质量 : W: 183.84 0: 16.00)
5.氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
|
|
|
![]()
![]()
![]()
![]()
![]() 工业CuSO4
CuSO4溶液 CuSO4·5H2O …… CuO
工业CuSO4
CuSO4溶液 CuSO4·5H2O …… CuO
①步骤I的目的是除不溶性杂质。操作是 。
②步骤Ⅱ的目的是除铁元素。操作是:滴加H2O2溶液,稍加热;当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是 。
③步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是 ,过滤,水浴加热烘干。水浴加热的特点是 。
⑵探究氧化铜的性质
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A 和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡。结论是 。
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有:
。
6.在长期载人太空飞行的宇航器中,每个宇航员平均每天需要消耗0.9kg氧气,呼出1.0kg二氧化碳。为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的科学探索。
方法一、有的科学家提出“金属过氧化物处理系统”,即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。有关反应的化学方程式是①_______________________②_______________________;将处理后的气体充入座舱时,应注意采取的一项措施是_______________________。
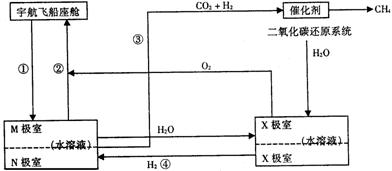 方法二、有科学家根据电解原理设计了飞船内空气更新实验系统,该系统结构示意图如下:
方法二、有科学家根据电解原理设计了飞船内空气更新实验系统,该系统结构示意图如下:
电化学二氧化碳处理系统 电解水系统
(1)管道①把飞船座舱中合较多二氧化碳的潮湿空气通入“电化学二氧化碳处理系统”的M极室,通过该电极反应可以使二氧化碳不断被吸收;该电极反应式为_______________,其电解产物吸收二氧化碳的离子方程式为____________________________________。在M极吸收二氧化碳后形成的离子会通过隔膜进入N极室,通过N极的电极反应可使二氧化碳从电解液中释放出来,并保持系统内的pH不变;该电极反应式为:__________
_____________________________________________,二氧化碳逸出的离子方程式为
___________________________________________________。
(2)管道②是将处理后的空气混入“电解水系统”产生的新鲜氧气,然后通入飞船座舱内供宇航员呼吸用。在“电解水系统”中,Y为____________极(填“阴”或“阳”),X极的电极反应式为_______________________。
(3)逸出的二氧化碳没有排出飞船外,而是通过管道③进入“二氧化碳还原系统”。在该系统内,二氧化碳跟氢气在一定条件下反应,其产物有甲烷等气体,请评价这样处理的重要意义_________________________________________________________________。
7.Ag/α-Al2O3中石油化学工业的一种重要催化剂,其中Ag起催化作用,α-Al2O3是载体且不溶于硝酸,该催化剂回收实验如下图所示。其中的转化反应为:
6AgCl + Fe2O3→3Ag2O + 2FeCl3
![]()
![]()
![]()
![]() Ag/α-Al2O3 HNO3 蒸馏水 NaCl
Ag/α-Al2O3 HNO3 蒸馏水 NaCl

![]() NOx α-Al2O3
NaNO3
NOx α-Al2O3
NaNO3
![]()
![]()
![]() NaOH溶液
HNO3 AgCl(s) Fe2O3
NaOH溶液
HNO3 AgCl(s) Fe2O3
 | |||
| |||
AgNO3晶体 FeCl3
 阅读上述实验流程,完成下列填空:
阅读上述实验流程,完成下列填空:
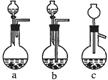
⑴Ag/α-Al2O3加酸溶解应该选用右图装置 (选填a、b、c)。
⑵在实验操作(Ⅱ),如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式 。
⑶实验操作(Ⅳ)所需玻璃仪器为(填写三种) 。
⑷在实验操作(Ⅶ)从AgNO3溶液获得AgNO3晶体需要进行的实验操作依次为: 。
①蒸馏 ②蒸发 ③灼烧 ④过滤 ⑤冷却结晶
⑸已知:NO + NO2 + 2NaOH →2NaNO2 + H2O;2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O。 NO和NO2的混合气体的组成可表示为NOx。该混合气体通入NaOH溶液被完全吸收时,x的值为 。
a. x≤1.5 b. x=1.2 c. x≥1.5
⑹已知Ag/α-Al2O3中Ag的质量分数计算Ag的回收率,还必须知道的实验数据为
和 。
参考答案:
 1.(1)稀,(a)、(c) (2)(a)、(c) (3)(b),Fe(OH)3、Cu(OH)2
1.(1)稀,(a)、(c) (2)(a)、(c) (3)(b),Fe(OH)3、Cu(OH)2
2.⑴ CaC2+2H2O→Ca(OH)2+C2H2↑,
⑵ 4 (1分) ⑶ 棕黄色溶液变无色或褪色 4.8
⑷ 合成氨原料 作燃料或有机化工原料(或其他合理答案)
3.(1)①NMMO ②S 、C ③副产物不会造成环境污染
![]() (2)①(C2H2)n ②2CH2===CH2
+ O2
(2)①(C2H2)n ②2CH2===CH2
+ O2![]() 2CH2-CH2 ③ACF
2CH2-CH2 ③ACF
O
4.(1)A: Na2W04; B: H2W04 C: W03
(2)2 W03 (s) +3C (s,石墨 ) ==2W (s) +3C02 (g) 因为钨的熔点很高 , 不容易转变为液态,如果用碳做还原剂 , 混杂在金属中的碳不易除去 , 而且碳会在高温下和金属钨反应形成碳化钨, 不容易获得纯的金属钨。用氢气作还原剂就不存在这些问题。(3) ①X=O. 10 ②n (W) (V): n (W) (VI) 1: 4
5.20、(1)①溶于水,过滤。 ②在此条件下Fe3+被沉淀并保证Cu2+不被沉淀。
③小心蒸发浓缩后,冷却结晶。 加热温度不会超过100℃,加热温度改变较缓慢
(2)①CuO对H2O2的分解反应有催化作用。
②盛满水的洗气瓶(或量气瓶)、量筒、导气管。
6.方法一、①2Na2O2+2CO2=2Na2CO3+O2 ②2Na2O2+2H2O=4NaOH+O2↑
补充适量的水蒸气。 方法二、(1)2H2O+O2+4e=4OH-;CO2+2OH-=CO32-+H2O;
2H2+4OH--4e=4H2O;CO32-+H2O=2OH-+CO2↑
(2)阴;4OH--4e=2H2O+O2↑ (3)生成的甲烷可做飞船的气体燃料,体现了物质的循环使用和充分利用。
7.⑴a ⑵Ag++ Cl- = AgCl↓ ⑶漏斗、烧杯、玻璃棒
⑷②⑤④ ⑸c ⑹催化剂的质量 AgNO3(s)的质量