高三化学电解质溶液专题复习训练
恩平一中 冯健文
1、下列叙述中,正确的是
①中和10mL0.1 mol/L醋酸与中和100mL0.01 mol/L醋酸所需同种碱液的量不同②体积相同、pH相等的盐酸和硫酸溶液中,H+的物质的量相等③常温下,pH=3的甲酸溶液中c(H+)与pH=11的氨水中的c(OH—)相等④锌与pH= 4的盐酸反应比跟pH=3的醋酸溶液反应程度剧烈
A.①③ B.①④ C.② D.②③
2、向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3: 1其原因可能是
A.两溶液的体积相同,酸是多元强酸
B.若酸为一元强酸,酸溶液的体积是碱溶液体积的3倍
C.两溶液的体积相同,酸是弱酸
D.酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
3、常温下,有甲、乙两份体积均为1 L,浓度均为0.1 mol·L-1的氨水,其pH为11。
①甲用蒸馏水稀释100倍后,溶液的pH将为a;②乙与等体积、浓度为0.2mol·L-1的HCl混合,在混合溶液中:n(NH4+)+n(H+)-n(OH-)=b mol 。则a、b正确的答案组合是
A.9~11之间; 0.1 B.9~11之间; 0.2
C.12~13之间; 0.2 D.13; 0.1
4、向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3: 1其原因可能是
A.两溶液的体积相同,酸是多元强酸
B.若酸为一元强酸,酸溶液的体积是碱溶液体积的3倍
C.两溶液的体积相同,酸是弱酸
D.酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
5、现有常温下的四份溶液:①0.01mol/LCH3COOH;②0.01mol/LHCl;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
A.①中水的电离程度最小,③中水的电离程度最大
B.将②、③混合,若有pH=7,则消耗溶液的体积:②>③
C.将四份溶液稀释相同倍数后,溶液的pH:③>④,②>①
D.将①、④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性
6、在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制CuCl2
是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法正确的是
A.加入纯Cu将Fe2+还原
B.向溶液中加入(NH4)2S使Fe2+沉淀
C.直接加水加热使杂质离子水解除去
D.在溶液中通入Cl2,再加入CuO粉末调节pH为4~5
7、一定温度下,取0.2 mol/L HX溶液与0.2 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化,下同)得溶液甲;另取0.2 mol/L HX溶液与0.1 mol/L NaOH溶液等体积混合得溶液乙。测得溶液甲的pH=8,溶液乙的pH>7。下列结论错误的是
A.甲溶液中由水电离出的c(OH¯) > 0.2 mol/L HX溶液中由水电离出的c(H+)
B.甲溶液中c(Na+) — c(X-)=1.0×10−8 mol/L
C.甲溶液中c(OH-) — c(HX) =1.0×10−8 mol/L
D.相同条件下,HX的电离程度 > NaX的水解程度
8、(1)某温度(t0C)时,水的KW=10—13,则该温度(填“大于”“小于”或“等于”) 250C,其理由是 。将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,若所得混合液为中性,则a:b= 。
![]() (2)已知250C时0.1mol/L醋酸溶液达到平衡(HAc H++Ac—)时的pH约为3,如果在此溶液中加入等体积的pH为5的盐酸,则电离平衡 (填“向左”“向右”或“不移动”);若向原醋酸溶液中加入少量醋酸钠晶体,待晶体溶解后溶液的pH值 (填“增大”“减小”或“不变”)。
(2)已知250C时0.1mol/L醋酸溶液达到平衡(HAc H++Ac—)时的pH约为3,如果在此溶液中加入等体积的pH为5的盐酸,则电离平衡 (填“向左”“向右”或“不移动”);若向原醋酸溶液中加入少量醋酸钠晶体,待晶体溶解后溶液的pH值 (填“增大”“减小”或“不变”)。
9、已知某溶液中只含有OH—、H+、Na+、CH3COO— 四种离子。
(1)若溶液中只溶解了一种溶质,则该溶质是_______________________。
(2)若溶液中c (CH3COO—)>c (Na+)>c (H+)>c (OH— ),则含有的溶质是
______________________________________。
(3)若溶液是由体积相等的NaOH溶液和CH3COOH溶液混合而成,且恰好呈中性,
则混合前c (CH3COOH)_________c (NaOH)(填“<”、“>”或“=”=。
10、⑴常温下将0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+);
(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)= mol/L;c(H+)-c(MOH)= mol/L。
⑵常温下若将0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
⑶常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH_________。(填“>7”、“<7”、或“无法确定”=
11、某温度下,水的离子积为Iw=1×10一12,则该温度 (填“<”、“>”、“=”)25℃,若将该温度下pH=11的Ba(OH)2溶液aL和pH=l NaHS04bL混和(设混和过程中的体积变化忽略不计),试填写下列空格.
(1)若所得溶液为中性,则a:b= ,此时,溶液的pH=
(2)若所得溶液pH=2,则a:b= ,此时,溶液中所含的主要离子
的浓度由大到小的顺序为
(3)若Ba2+和S042一恰好完全沉淀,a:b=
12、(1)某温度时,水的离子积为K![]() =1×10
=1×10![]() ,将此温度下pH=10的苛性钠溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),若所得溶液的pH=6,则a:b=__________,此溶液中各种离子的浓度由大到小的排列顺序是____________________。
,将此温度下pH=10的苛性钠溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),若所得溶液的pH=6,则a:b=__________,此溶液中各种离子的浓度由大到小的排列顺序是____________________。
(2)已知某溶液中只含有四种离子:A![]() 、B
、B![]() 、H
、H![]() 、OH
、OH![]() ,对这四种离子浓度的大小比较,有以下三种顺序。在你认为正确的顺序后面的空格内填写由A
,对这四种离子浓度的大小比较,有以下三种顺序。在你认为正确的顺序后面的空格内填写由A![]() 和B
和B![]() 组成物质的化学式(只写一种情况即可);在你认为不正确的顺序后面的空格内填写不正确的原因。供选择的离子有:
组成物质的化学式(只写一种情况即可);在你认为不正确的顺序后面的空格内填写不正确的原因。供选择的离子有:
Na![]() 、Ag
、Ag![]() 、NH
、NH![]() 、Cl
、Cl![]() 、NO
、NO![]() 、CH
、CH![]() COO
COO![]() 、H
、H![]() 、OH
、OH![]()
①
c(B![]() )>c(A
)>c(A![]() )>c(H
)>c(H![]() )>c(OH
)>c(OH![]() ):______________________________。
):______________________________。
②
c(A![]() )>c(B
)>c(B![]() )>c(OH
)>c(OH![]() )>c(H
)>c(H![]() ):______________________________。
):______________________________。
③
c(H![]() )>c(B
)>c(B![]() )>c(A
)>c(A![]() )>c(OH
)>c(OH![]() ):___________________________________。
):___________________________________。
13、已知氢氧化镁饱和溶液中存在下列平衡,且Mg2+和OH-的物质的量浓度存在下列关系:c(Mg2+)• c(OH-)2=Ksp,Ksp是一常数。
![]() Mg(OH)2 (s)
Mg2+(aq)+2OH-(aq)
Mg(OH)2 (s)
Mg2+(aq)+2OH-(aq)
某学生在toC下用纯水制备了一份氢氧化镁饱和溶液,测得溶液的pH为10。
(1)用上述测定数据计算在toC时氢氧化镁的溶解度(用mol·L-1单位表示)。
(2)计算在toC氢氧化镁的Ksp。
(3)计算toC时在0.010 mol·L-1 NaOH中氢氧化镁的溶解度(用mol·L-1单位表示)。
(4)toC下将10g Mg(OH)2和100mL 0.100 mol·L-1 HCl的混合并充分搅拌,计算该混合体系中达平衡时溶液的c(OH-)。
14、对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。
若25℃时有HA![]() H++A—,则K==
H++A—,则K==
式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH | 1.76×10—5 |
| H2CO3 | H2CO3 HCO3— | K1==4.31×10—7
K2==5.61×10—11 |
| H2S | H2S HS— | K1==9.1×10—8
K2==1.1×10—12 |
| H3PO4 | H3PO4 H2PO4— HP42— |
K1==7.52×10—3 K2==6.23×10—8
K3==2.20×10—13 |
回答下列各题:
(1)K只与温度有关,当温度升高时,K值__________(填“增大”、“减小”、“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?_____________________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是__________,最弱的是_____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是________________,产生此规律的原因是___________________________________。
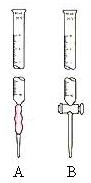 15.(12分)已知:KMnO4、MnO2在酸性条件下均能将草酸钠氧化,Mn元素均被还原为Mn2+。某研究小组为测定软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品置于一烧杯中,加入2.68g草酸钠固体,再加入过量的稀硫酸并加热(杂质不参加反应并且不溶于酸),充分反应后冷却、滤去杂质,将所得溶液全部转移到100mL容量瓶中并定容后备用;准确量取20.00mL 0.0400mol·L-1的KMnO4标准溶液置于锥形瓶中,再从容量瓶中取出部分溶液置于一洁净且不漏水的滴定管中进行滴定,当滴入25.00mL待测液时恰好完全反应。请回答下列问题:
15.(12分)已知:KMnO4、MnO2在酸性条件下均能将草酸钠氧化,Mn元素均被还原为Mn2+。某研究小组为测定软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品置于一烧杯中,加入2.68g草酸钠固体,再加入过量的稀硫酸并加热(杂质不参加反应并且不溶于酸),充分反应后冷却、滤去杂质,将所得溶液全部转移到100mL容量瓶中并定容后备用;准确量取20.00mL 0.0400mol·L-1的KMnO4标准溶液置于锥形瓶中,再从容量瓶中取出部分溶液置于一洁净且不漏水的滴定管中进行滴定,当滴入25.00mL待测液时恰好完全反应。请回答下列问题:
⑴ 写出MnO2氧化草酸钠的离子方程式 ;
⑵ 将MnO2氧化草酸钠后的溶液全部转移到100mL容量瓶中的具体操作是 ;
⑶ 从容量瓶中取出的部分溶液应置于 (选填“A”或“B”)滴定管中;滴定前必须进行的操作是 ,滴定过程中是否需要指示剂 (选填“是”或“否”),若回答“是”,请写出指示剂的名称;若回答“否”,请写出判断滴定终点的依据 ;
⑷ 你能否帮助该研究小组求得软锰矿中MnO2的质量分数 (选填“能”或“否”),若回答“能”,请求出计算结果;若回答“否”,请说明原因 。
参考答案
1、D 2、C 3、B 4、C 5、B 6、D 7、BD
8、(1)大于;250C时KW=10—14,升高温度水的电离平衡正向移动,使KW增大 。10∶1。
(2)向右; 增大。
9、(1)CH3COONa (2)CH3COOH和CH3COONa (3)>
10、⑴①> ② 9.9×10-7 、 1.0×10-8 ⑵< ⑶<7
11、(1)> 、6 (2) 9:11 、 c(Na+)>c(SO42-)> c(H+)>c(OH-) (3) 2:1
12、(1)10:1
c(Na![]() )>c(SO
)>c(SO![]() )>c(H
)>c(H![]() )=c(OH
)=c(OH![]() )(或:c(Na
)(或:c(Na![]() )=2c(SO
)=2c(SO![]() )>c(H
)>c(H![]() )=c(OH
)=c(OH![]() ))
))
(2)①NH![]() Cl(或AgNO
Cl(或AgNO![]() 或NH
或NH![]() NO
NO![]() ) ②CH
) ②CH![]() COONa
COONa
③因为c(A![]() )+c(H
)+c(H![]() )>c(B
)>c(B![]() )+c(OH
)+c(OH![]() ),不遵循电荷守恒(其它合理解释同样给分)
),不遵循电荷守恒(其它合理解释同样给分)
13、(1)5×10-5 mol/L (2)5×10-9 (3)5×10-13 mol/L (4)c(OH-)= 1×10-5mol/L
14、(1)温度升高,促进电离,所以K值增大
(2)K值越大,电离出的氢离子浓度越大,所以酸性越强
(3)H3PO4 HPO42—
(4)K1:K2:K3≈1:10—5:10—10 上一级电离产生的H+对下一级电离有抑制作用
15、(12分)⑴ MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O
⑵ 将烧杯中的溶液沿玻璃棒倒入容量瓶中,再用少量蒸馏水洗涤烧杯2~3次,洗涤液均沿玻璃棒倒入容量瓶中
⑶ B 准确读数并记录 否 当滴入最后一滴待测液时,锥形瓶中的溶液由红色变为无色并在半分钟内不再显红色
⑷ 能 87.0%