第四章 非金属及其化合物
第三讲 硫和氮的氧化物
教学难点:可逆反应,二氧化氮与水的反应。
知识梳理
【知识链接】目前我国空气质量报告主要依据哪些污染物?___、____、_____。
1、二氧化硫的来源:
实验室:_S+_O2— ; _Cu+_H2SO4(浓)—______;
_Na2SO4+_H2SO4(浓)— ______
工业上:____________工业尾气,_FeS2+_O2—_________。
2、氮氧化物的来源:_NH3+_O2— ______;汽车尾气。
一、二氧化硫
1、硫,俗称 , 色粉末
2、二氧化硫的物理性质
二氧化硫是 色、有 气味的 气体,密度比空气 ,易 , 溶于水。
3、二氧化硫的化学性质
二氧化硫与水的反应,水溶液的酸碱性,二氧化硫或亚硫酸的漂白性实验:
| 实验操作 | 现象 | 结论 |
| (1)把盛有SO2的试管倒立于水中,打开胶塞 | 试管内液面 。 | SO2 溶于水。 |
| (2)用pH试纸测定溶液的酸碱度 | _________溶液呈 性。 | |
| (3)滴入2滴品红溶液,振荡;加热试管,再观察 | ; 。 |
【思考】分别从化合价的角度,作为酸性氧化物的角度,二氧化硫有什么化学性质:
______________________________________________________________________________。
(1)SO2与水的反应方程式为______________________。
【概念辨析】可逆反应:在 下,既能向 方向进行,同时又能向 方向进行的反应。
(2)SO2与NaOH溶液的反应方程式为______________________。另举两例反应酸性氧化物这一通性的化学反应:________________________________,________________________。
(3)SO2与O2的反应——二氧化硫表现____________性,反应方程式为_____________________。
【注意】工业上制硫酸的反应
____________________________,_________________________,_________________。
【思考】硫酸酸雨如何形成?写出反应的方程式
________________________________________________________________________
(4)SO2或亚硫酸有漂白性:二氧化硫或亚硫酸有漂白作用,与有色物质发生化合反应,生成不稳定的无色物质,加热又恢复为原来的颜色。利用品红溶液可检验二氧化硫气体。
【辨析】氯水也有漂白作用,次氯酸与有色物质发生氧化还原反应,生成稳定的无色物质,加热不恢复为原来的颜色。
二、二氧化氮和一氧化氮
1、中国有句农谚,叫“雷雨发庄稼”,其中蕴含着丰富的科学知识。用化学方程式表示:
________、_____________、_____________。
2、小结表-1:
|
| NO | NO2 | SO2 | SO3 |
| 物理性质 |
|
|
|
|
| 化学性质 |
|
|
|
|
| 用途 |
|
|
|
|
| 对环境影响 |
|
|
|
|
| 制法 |
|
|
|
|
表-2
|
| 氮 | 硫 | ||||
| 物理性质 | NO2 | NH3 | HNO3 | SO2 | SO3 | H2SO4 |
| 化学性质 |
|
|
|
|
|
|
| 用途 |
|
|
|
|
|
|
| 制法 |
|
|
|
|
|
|
【练习】1、NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、提高免疫、增强记忆的功能,而成为当前生命科学的研究热点,NO亦被称为“明星分子”。请回答下列问题。
①NO对环境的危害在于 (填以下项目的编号)
A.破坏臭氧层B.高温下能使一些金属被氧化C.造成酸雨D.与人体血红蛋白结合
②在含Cu+离子的酶活化中心中,亚硝酸根离子(NO2-)可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:
③在常温下,把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式: ___
④简要说明变化③中为什么最后的气体总压力小于原压力的2/3 _____
2、下列物质中,不属于空气质量指标的是
A.二氧化碳 B.氮氧化物 C.二氧化硫 D.悬浮颗粒
3、你认为减少酸雨产生的途径可采取的措施是
①不用煤作燃料②把工厂烟囱造高③燃料脱硫④在已酸化的土壤中加石灰⑤开发新能源
A. ①②③ B. ②③④⑤ C. ①③⑤ D. ①③④⑤
4、SO2溶于水后所得溶液的性质是
A.有氧化性,无还原性,无酸性 B.有氧化性,有还原性,有酸性
C. 有还原性,无氧化性,无酸性 D. 有还原性,无氧化性,有酸性
5、酸雨放置时酸性略有增强,原因是:(写化学反应方程式)
。
疑难点拨
一、常见具有漂白剂有那些?原理有何区别?
1、与有机色素结合成不稳定的无色物质。
SO2漂白性的实质,是SO2与水反应生成的H2SO3跟有机色素结合成了不稳定的无色化合物,该化合物见光、遇热或长久放置又能恢复为原来的颜色。SO2漂白原理属于非氧化—还原反应。
2、氧化性漂白:漂白剂具有氧化性,将有机色素氧化成稳定的无色物质。
(1)氯水、Ca(ClO)2的漂白性:干燥的氯气不能使红布条褪色,而能使湿润的红布条褪色,证明起漂白作用的不是Cl2,而是HClO。氯气也能使品红溶液褪色,但加热不能复原,其实质为氧化还原反应。Ca(ClO)2在水中极易发生水解,或与CO2反应生成HClO,从而表现出漂白性。
(2)H2O2、Na2O2的漂白性:过氧化氢在常温下能自动分解:2H2O2=2H2O+O2↑,因此它是一种强氧化剂,纺织工业常用它作漂白剂,就是利用它的氧化性。Na2O2是一种淡黄色晶体,与水或者稀酸作用时,生成过氧化氢,并猛烈放热。生成的H2O2在受热情况下立即分解放出氧气,表现出强氧化性:2Na2O2+2H2O=4NaOH+O2↑。因此,Na2O2是一种重要的工业漂白剂。
(3)臭氧的漂白性:O3分子是不稳定的,氧化能力远比O2强,且在水溶液中具有强氧化性。所以,当有水存在时,O3是一种强力漂白剂,还用于水和空气的消毒。
3、吸附性漂白:木炭、活性炭具有疏松多孔的结构,形成较大的比表面积,具有很强的吸附性。
二、二氧化碳与二氧化硫的异同及鉴别
1、物理性质。相同点:常温下都是无色气体.密度都大于水。
不同点:二氧化碳没有气味.二氧化硫有刺激性气味;二氧化碳无毒.二氧化硫有毒;二氧化碳能溶于水(1体积水大约溶解1体积气体)。二氧化硫易溶于水(1体积水大约溶解
40体积气体);二氧化硫易液化。
2、化学性质。相同点:都是酸性氧化物①都能和水反应.生成的酸不稳定.只能存在于溶液中CO2+H2O![]() H2CO3 SO2+H2O
H2CO3 SO2+H2O![]() H2SO3
H2SO3
②都能与碱反应。用量比不同。可以生成两种盐。SO2、CO2气体通入澄清石灰水中。都是先生成沉淀。当SO2、CO2过量时又溶解。
不同点:①二氧化硫常表现还原性.二氧化碳表现氧化性;二氧化硫能被高锰酸钾、氯水、溴水、碘水等氧化剂氧化.二氧化碳不能.②二氧化硫具有漂白性.能漂白某些有色物质.二氧化碳不能。③造成大气污染的原因不同。二氧化硫形成酸雨,二氧化碳引起温室效应。
3、鉴别:①利用二氧化硫的还原性,用高锰酸钾溶液或溴水褪色鉴别。②利用二氧化硫的漂白性,用品红溶液鉴别。
三、氮的氧化物溶于水的计算
1、NO2或NO2与N2(非O2)的混合气体溶于水时,可根据反应:3NO2+H2O=2HNO3+NO,利用气体
体积的变化差值进行计算.
2、NO2和O2的混合气体溶于水时,根据反应:4NO2+O2+2H2O=4HNO3
当V(NO2)∶V(O2)

3、NO和O2同时通入水中时,此时的反应为:4NO+3O2+2H2O=4HNO3
当V(NO) ∶V(O2)

典例剖析
【例1】北京市最近规定进京汽车尾气排放必须符合国家标准。因为汽车尾气(含烃类、CO、SO2与NO等有毒气体)是城市空气的污染源。治理的方法之一是在汽车的排气管上,装一个催化转换器(用Pt、Pd合金作催化剂),它的特点是使CO和NO反应,生成参与大气生态循环的无毒气体,并使汽油充分燃烧及SO2转化。
(1)写出NO和CO通过催化转换器发生反应的化学方程式:
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度。其原因是:
(3)控制城市空气污染源的方法有:
a.植树造林 b.开发氢能源 c.使用非机动车 d.控制汽车进城 e.使用无铅汽油
解析:一辆以汽油为燃料的汽车有几个地方排出污染物,其中最主要的是尾部排出的废气。废气中主要含CO、NOx及碳氢化合物。CO是汽油不完全燃烧的产物,NOx是汽油爆裂时,进入的空气中氮和氧化合而成。碳氢化合物中含有烷烃、烯烃和芳烃、醛等,有的是汽油原有成分,有的是氧化产物。让学生明确汽车尾气成分有利于认识尾气对环境的污染,有利于要治汽车尾气。大城市中汽车多,大气中NO含量较高这是因为,汽车引擎在工作时产生高温高压使之发生如下反应:N2+O2=2NO,矿物油中硫在燃烧过程中产生SO2,不完全燃烧产生CO,治理方法是在汽车排气管上装一个用铂、钯合金作的“催化转化器”,使之发生反应,NO与CO反应生成N2和CO2,SO2催化氧化为SO3。控制城市空气污染源的根本方法是植树造林和开发无污染的氢能源。
答案:(1)2CO+2NO![]() N2+2CO2 2SO2+O2
N2+2CO2 2SO2+O2![]() 2SO3 (2)反应除生成了N2外,还生成了增加空气酸度的CO2和SO3 (3)a、b
2SO3 (2)反应除生成了N2外,还生成了增加空气酸度的CO2和SO3 (3)a、b
【例2】虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体
产物,填写下列空白:
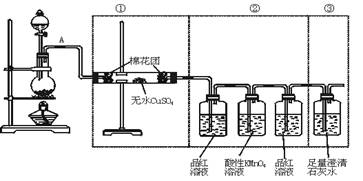
(1)如果将装置中①②③三部分仪器的连接顺序变为②①③,则可以检出的物质是______;不能检出的物质是______。
(2)如果将仪器的连接顺序变为①③②,则可以检出的物质是______;不能检出的物质
______。
(3)如果将仪器的连接顺序变为 ②③①,则可以检出的物质是______;不能检出的物
______。
解析:要正确解答本题务必清楚题给实验装置各部分的作用及排列顺序不可变更的原因.装置①为检验产物H2O,只能放在装置②③之前,因为若放在装置②③之后或装置②③之间,则气流通过装置②或③一定要带出水蒸气,则无法验证使CuSO4变蓝的水蒸气是否是反应生成物.装置③和装置②位置也不得变更,因为SO2、CO2均能使澄清石灰水变浑浊.故
验证CO2前一定要排除SO2的干扰。答案:(1)SO2、CO2 H2O (2)SO2 CO2 (3)SO2、CO2 H2O
知能训练
一、选择题
1.下列污染现象主要与SO2有关的是 ( )
A.臭氧空洞 B.酸雨 C.光化学烟雾 D.温室效应
2、飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降。它与空气中的SO2和O2
接触时,SO2会部分转化为SO3,使空气的酸度增加,环境污染更为严重。其中飘尘所起的作用可能是:
A.氧化剂 B.还原剂 C.催化剂 D.载体
3.酸雨给人类带来了种种灾祸,严重地威胁着地球生命生存的生态环境,下列有关减少或者防止酸雨形成的措施中可行的是 ( )
①对燃煤进行脱硫;②对含SO2、NO2等工业废气进行无害处理后,再排放到大气中;③
人工收集雷电作用所产生的氮的氧化物;④飞机、汽车等交通工具采用清洁燃料,如天然气、甲醇等。
A.①②③④ B.①②③ C.①②④ D.①③④
4.某冶炼厂利用炼铜产生的SO2生产硫酸,变废为宝,化害为利。其原理是 ( )
A.利用了SO2的水溶性,将SO2直接通入水中
B.利用了SO2的氧化性,将SO2直接通入水中
C.利用了SO2的氧化性,使其与O2反应而转化为SO3,再与水反应
D.利用了SO2的还原性,使其与O2反应而转化为SO3,再与水反应
5、在常温常压下,下列各组气体不能共存的是 ( )
A.SO2与O2 B.NO2与NO C.O2与N2 D.NO与O2
6.下列气体溶解于水,没有发生氧化还原反应的是 ( )
A.SO2溶解于水 B.NO2溶解于水 C.CO2溶解于水 D.Cl2溶解于水
7.某冶炼厂利用炼铜产生的SO2生产硫酸,变废为宝,化害为利。其原理是 ( )
A.利用了SO2的水溶性,将SO2直接通入水中
B.利用了SO2的氧化性,将SO2直接通入水中
C.利用了SO2的氧化性,使其与O2反应而转化为SO3,再与水反应
D.利用了SO2的还原性,使其与O2反应而转化为SO3,再与水反应
8.右图是化学实验常用装置之一,若气体从右管进入,可用来收集的气体是 ( )
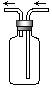
A.NO B. NO2 C. CO D.SO2
9.全社会都在倡导诚信,然而总是有一部分不法商贩却在背道而驰。如有些商贩为了使银耳增白,就用硫磺(燃烧硫磺)对银耳进行熏制,用这种方法制取的洁白的银耳对人体是有害的。这些不法商贩所制取银耳利用的是 ( )
A.S的漂白性 B.S的还原性 C.SO2的漂白性 D.SO2的还原性
10.上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。下列关于NO的说法错误的是 ( )
A.NO是具有刺激性的红棕色气体 B.NO是汽车尾气的有害成分之一
C.NO在人体的血管系统内具有传送信号的功能
D.NO能够与人体血红蛋白结合,造成人体缺氧中毒
11.如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的可能是什么气体( )
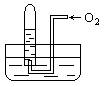
A.可能是N2与NO2的混和气体 B.可能是O2与NO2的混和气体
C.可能是NO与NO2的混和气体 D.只可能是NO2一种气体
12.某混合气体中可能含有Cl2 、O2 、SO2 、NO 、NO2 中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是 ( )
A. 肯定有SO2 和NO B. 肯定没有Cl2 、O2和NO2
C. 可能有Cl2和O2 D. 肯定只有NO
13.盛有NO 和 NO2 的混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半 。则原混合气体中NO 和 NO2 的体积比是 ( )
A.3∶1 B.1∶3 C.2∶1 D.1∶2
二、填空题
14.用仪器A、B和胶管组成装置收集NO气体(①仪器A已经气密性检查;②除水外
不能选
用其他试剂)。
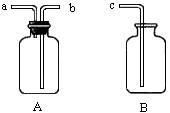
正确的操作步骤是:
15.利用右图装置,写出除去下列气体中的杂质的方法,并写出化学方程式
(括号内的气体为杂质)。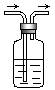
(1)CO2(SO2) ,化学方程式 。
(2)SO2(SO3,假设SO3为气体) ,化学方程式 。
(3)NO(NO2) ,化学方程式 。
16、有一无色干燥的混合气体,可能是由HCl、NO、NO2、CO2、NH3、H2、O2、Cl2中的几种混合而成,根据①把混和气体通过浓H2SO4时,气体体积明显减小。②再通入过量碱石灰时,体积又明显减小;③剩余气体接触空气时,立即变为红棕色,可得:混和气体中一定存在______________,一定不存在_______________,可能存在_________ 。
三、计算题
17、将vmL NO和NO2的混合气通过水吸收后,得到amL无色气体A,将此无色气体A与等体积O2混合,再通过水充分吸收后,收集到5mL无色气体B。试回答:
(1)A气体是 ,B气体是 ;
(2)A气体的体积是 mL;
(3)v的取值范围是 。
18、将标况下4升NO2和1升O2混合充满烧瓶,然后倒插入水槽中,溶液的物质的量浓度是多少?(假设硝酸未进入水槽)若是4升NO和3升O2,浓度又是多少?若是NO2、NO、O2的混合气体,也是刚好溶于水完全反应,则溶液的浓度在什么范围内?
参 考 答 案
1.B 2. C 3.C 4.D 5.D 6.AC 7.D 8.BD 9.C 10.A 11.BC 12.AB 13.B
14、 在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a导入NO气体,水通过b和c
排入B中。
15.(1)将混和气体通入到盛有饱和NaHCO3溶液的上图装置中,化学方程式是:
SO2+2NaHCO3=2CO2↑+Na2SO3+H2O
(2)将混和气体通入到盛有饱和NaHSO3溶液的上图装置中,化学方程式是:
SO3+2NaHCO3=2SO2↑+Na2SO4+H2O
(3)将混和气体通入到盛有水的上图装置中,化学方程式是:
3NO2+H2O=NO+2HNO3
16、NH3、CO2、NO, HCl、Cl2、NO2、O2, H2 。
17.(1)NO2溶于水生成NO,故A为NO,B为O2
(2)4NO+3O2+2H2O=4HNO3
amL ![]()
依题意:![]() (2分)
(2分)
(3)在VmL的混合气中,因3体积的NO2只能产生1体积的NO,故V应大于20mL。若20mLNO都由NO2产生,则V应为60mL,已知VmL气体中已含NO,故20<V<60(20分)
18.0.036mol/L;0.026mol/L;0.026mol/L<C<0.036mol/L
知识梳理练习1
答案:①A、C、D②Cu+ +
NO2-+ 2H+ = Cu2+
+ NO + H2O③ 3NO![]() N2O
+ NO2④存在化学平衡:2NO2
N2O
+ NO2④存在化学平衡:2NO2 ![]() N2O4
N2O4