高三化学复习二模测试题
注意事项:
1. 本试卷分选择题和非选择题二部分,共计150分, 考试时间为120分钟
2.选择题答题时,选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑.
3.可能用的相对原子质量:H:1 Si:28 Br:80 Ag:108 O:16 C:12 Al:27 Fe : 56 Cu: 64 Mn:55 Na:23
第一部分 选择题(共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.茂名濒江临海、环境宜人。下列举措不利于茂名继续保持良好环境的是
A.推广使用太阳能、风能等洁净能源,减少煤气、液化气的使用量
B.分类回收垃圾,充分利用再生资源
C.鼓励市民购置和使用汽车,加快城市交通现代化
D.在农村推广使用沼气
2.下列叙述不正确的是 ( )
A.金刚砂的成分是Al2O3,可用作砂纸、砂轮的磨料
B.水晶和玛瑙的主要成分都是SiO2
C.含硅的钢具有良好的导磁性
D.太阳能电池可用硅材料制作,其应用有利于环保、节能
3.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于
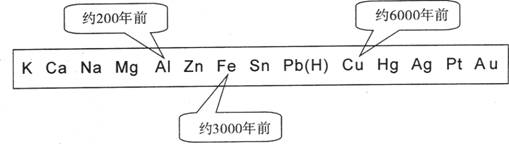
A.金属的化合价高低 B.金属的活动性大小
C.金属的导电性强弱 D.金属在地壳中的含量多少
4.下列说法中,正确的是
A.不可能有非金属单质置换出金属单质的置换反应
B.仅由非金属元素组成的化合物一定是共价化合物
C.能用同一通式表示的几种物质一定互为同系物
D.电能与化学能的相互转化过程中一定有新物质产生
5.2006年诺贝尔化学奖授予美国科学家Roger.D.Kormberg,他揭示了真核生物体内的细胞如何利用基因内存储的信息生产蛋白质。下列关于蛋白质的说法中正确的是
A.蛋白质均为天然有机高分子化合物,没有蛋白质就没有生命
B.蛋白质均易溶于水,均能跟浓硝酸作用变黄
C.HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性
D.可以采用多次盐析或多次渗析的方法分离提纯蛋白质
6.超酸是指酸性比普通无机酸强106~1010倍的酸,魔酸(HSO3F-SbF5)是已知超酸中最强的,许多物质如H2SO4在魔酸中可获得质子。则硫酸溶于魔酸中所表现出的这种性质是
A.碱性 B.酸性 C.还原性 D.氧化性
7.NH4Cl是强酸弱碱盐,它在水溶液里的水解过程可用下图表示:
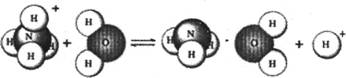
则下列有关NH4 Cl溶液里存在的微粒的叙述,不正确的是
A.存在NH3·H2O,其结构式为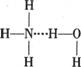 B.存在NH4+,其电子式为
B.存在NH4+,其电子式为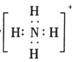
C.存在H3O+,其结构式为![]() D.存在OH-,其电子式为
D.存在OH-,其电子式为![]()
8.下列说法中正确的是 ( )
A.ⅠA、ⅡA族元素的原子,其半径越大,越难失去电子
B.元素 周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.原子及其离子的核外电子层等于该元素所在的周期数
D.所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等
9.化合物X、Y一定条件下发生如下反应:X+Y→Z+H2O若Z是一种单质,Z可能是
A.Fe B.C C.N2 D.F2
10.化学实验设计和操作中必须十分重视安全问题和环境保护问题。下列实验问题处理方法不正确的是 ( )
①在制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞
②在气体发生装置上直接点燃一氧化碳气体时,必需要先检验一氧化碳气体的浓度。最简单的方法是用排空气的方法先收集一试管气体,点燃气体,听爆鸣声。
③实验结束后将所有的废液倒入下水道排出实验室, 以免污染实验室
④给试管中的液体加热时不时移动试管或加入碎瓷片,以免暴沸伤人
⑤不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛
⑥配制浓硫酸时,可先在烧杯中加一定体积的水,再边搅拌边加入浓硫酸
A.①② B.②③ C.③⑤ D.②⑥
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案只包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
11.反应⑴是自海藻灰中提取碘的主要反应,反应⑵是自智利硝石中提取碘的主要反应:
2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2 …………⑴
2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2 …………⑵
下列有关说法正确的是
A、NaI 和NaIO3在一定条件下能反应生成I2
B、I2在反应⑴中是还原产物,在反应⑵中是氧化产物
C、⑴⑵两个反应中生成等量的I2时转移的电子数为1:5
D、氧化性:MnO2>IO3->I2>SO42->Mn2+
12.下列各项操作中,不发生“先产生沉淀后沉淀又溶解”现象的是
A.向饱和碳酸钠溶液中通入过量的CO2
B、 向Fe(OH)3胶体中逐滴滴加入过量的稀硫酸
C、向氨水中逐滴加入AgNO3溶液至过量
D、向石灰水中通入过量的CO2
⑤向硅酸钠溶液中逐滴加入过量的盐酸
13.可以用来判断醋酸属于弱电解质的实验事实是
A.醋酸属于共价化合物
B.醋酸钠溶液呈碱性
C.相同条件下,相同物质的量浓度的醋酸溶液的导电性较盐酸溶液的导电性弱
D.醋酸能与水以任意比混溶
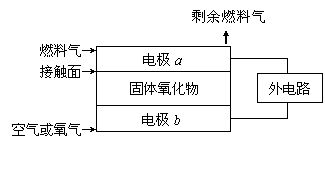 14.固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,O2-可以在其内部自由通过。其工作原理如右图所示:下列关于固体燃料电池的有关说法正确的是
14.固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,O2-可以在其内部自由通过。其工作原理如右图所示:下列关于固体燃料电池的有关说法正确的是
A.电极b为电池负极,电极反应式为O2+4e-=4O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为H2+2OH--4e-=2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-=2CO2+2H2O
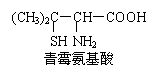 15.青霉素是医学上一种常用的抗生素,在体内经酸性水解后,得到青霉氨基酸,其结构简式如右图所示 (分子中的-SH与—OH具有类似性质)。
15.青霉素是医学上一种常用的抗生素,在体内经酸性水解后,得到青霉氨基酸,其结构简式如右图所示 (分子中的-SH与—OH具有类似性质)。
下列关于青霉氨基酸的推断合理的是
A.青霉氨基酸分子中所有碳原子均在同一直线上
B.青霉氨基酸具有两性并能发生酯化反应
C.青霉氨基酸分子间能形成多肽
D.1mol青霉氨基酸与足量的金属钠反应生成0.5mol H2
16.下列溶液中,有关离子一定能大量共存的是 ( )
A.能使石蕊呈蓝色的溶液中:Na+、I-、Cl-、NO![]()
B.能使甲基橙呈黄色的溶液中:![]()
C.能使pH试纸变红色的溶液中:![]()
D.能跟金属铝反应生成氢气的溶液中:![]()
17.阿伏加德罗常数约为6.02×1023mol-1 ,下列说法中,正确的是
A.22.4 L HCl中含有的分子数约为6.02×1023
B.l mol C22H46中含有的C—C键个数约为21×6.02×1023
C.常温常压下,由6 g NO2和40 g N2O4组成的混合气体中原子总数约为3×6.02×1023
D.1 mol Na2O2中所含的阴离子数约为2×6.02×1023
![]() 18.在一体积不变的密闭容器中发生如下化学反应:2A(g) B(g)+C(g)。当物质A的起始浓度为1.0 mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:
18.在一体积不变的密闭容器中发生如下化学反应:2A(g) B(g)+C(g)。当物质A的起始浓度为1.0 mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:
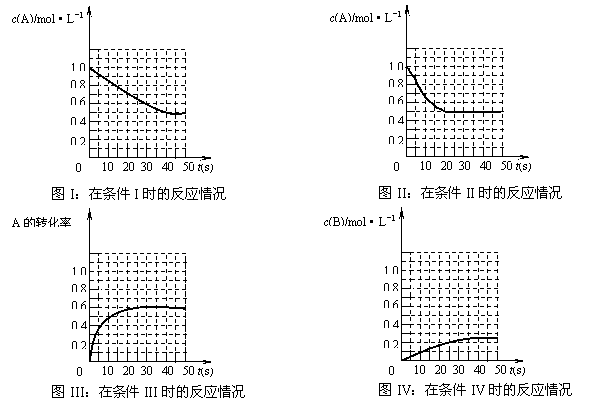 |
下列有关说法中正确的是
A.条件I、条件II时的反应温度不同,压强相同
B.条件I时可能未使用催化剂,条件II时可能使用了催化剂
C.条件III时的平衡混合物中,物质C的浓度等于0.6 mol·L-1
D.条件IV和条件II相比较,条件IV时可能增大了反应体系的压强
19.用水处理金属钠与碳化钙的混合物,有气体放出,此气体在催化剂作用下恰好完全反应,生成另一种气体,后者完全燃烧时,需要3倍体积的氧气,则金属钠与碳化钙的物质的量之比是 ( )
A.2:1 B.1:2 C.4:1 D.1:4
20. 下列反应的离子方程式正确的是
A.硫酸亚铁在空气中氧化: 4Fe2++3O2+6H2O=4Fe(OH)3
B.向Ba(OH)2溶液中加入少量NH4HSO4溶液:
|
C.用石墨电极电解CuSO4溶液:Cu2++4OH-====2Cu+O2↑+2H2O
D.用澄清石灰水吸收过量二氧化碳气体: OH-+CO2=HCO3-
第二部分 非选择题(共80分)
三、(本题包括3小题,共30分)
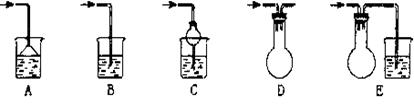
21.(8分)(ⅰ) 实验室中吸收尾气的方法很多。下列装置中可以用来吸收氨气的是(填序号,多填倒扣分)____________________。
(ⅱ) 粗盐经提纯后得到NaCl溶液,再经蒸发、结晶、烘干得精盐。
⑴蒸发操作中使用到的瓷质仪器的名称为____________________。
⑵该同学将所得精盐配成溶液,用于另一实验。实验中需要用80mL,1mol/L的NaCl溶液,配制过程中用托盘天平称取的精盐质量为_________g,用于定容的仪器的规格和名称_______________________________。
22.(12分)化学课外小组在查阅资料时发现一个故事:古代道士炼丹时得到了一种红色的丹砂,被他们认为是长生不老的灵丹妙药,曾献给皇上服用,结果……
他们在资料上又得到了丹砂是由两种元素组成的化合物。为探究丹砂的成分,他们称取ag丹砂并设计出了下列实验方案:
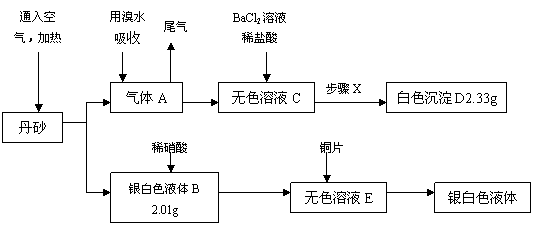 |
请回答下列问题:
(1)a= ;丹砂的化学式是 。
(2)指出丹砂中原子序数较小的元素所在周期表中的位置: 。
(3)步骤X是一组系列操作,它们是: 。
(4)写出离子反应方程式:
A→C: ;B→E: 。
(5)另外一组化学课外活动小组也分析并试做了他们设计的实验,但小青试做时得到的D的质量小于2.33g,请你帮助分析小青可能存在的问题(至少两个)
① ;② 。
小明发现上组的同学设计方案中有一个明显的缺陷:往B中加入稀硝酸时会产生大量的污染气体,于是他建议增设一个气体的吸收装置。请你帮助小明在方框中画出吸收该有毒气体的装置图(要求指出吸收剂的名称)。
 |
23、(10分)资料:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计的实验方案如下
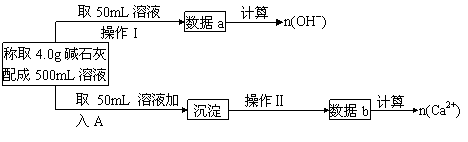

①操作I名称是________________;
②试剂A是_____________;
③实验中,测量得到的数据如下,其中n(OH-)=x mol,n(Ca2+)=y mol,请填写下表:
| 碱石灰的 可能组成 | NaOH,CaO | NaOH,CaO ,Ca(OH)2 | NaOH,Ca(OH)2 | NaOH, Ca(OH)2,H2O |
| x、y之间关系式(等式或不等式) | 40x-24y<4.0<40x-6y |
(2)第二小组查得如下资料:氢氧化钙在250℃时不分解,氢氧化钠在580℃时不分解。他们设计了如下方案:__________________________________________________________________________________________________________________________________________________________。
四、(本题包括3小题,共30分)
24、(12分)常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的PH值逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如下图所示
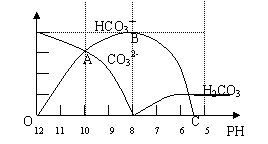 |
回答下列问题:
(1)在0.1mol/LNa2CO3溶液中C(Na+):C(CO32-) 2(填“﹤”或“﹥”或“=”)。其溶液中所有阳离子和阴离子的浓度有何关系?(用等式表示) 。
(2)在20mL 0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10-7g时开始产生沉淀X,则
KSP(X)= 。
(3)当加入盐酸使溶液PH值为10时,混合液中含碳元素的离子有哪些? ,其物质的量之比为 。
(4)随着盐酸的加入,HCO3-离子的浓度变化趋势是 ;请写出OAB段的离子方程式 和BC段的离子方程式 。
(5)当混合液的PH= 时,开始放出CO2气体。
25.(10分)(1)铍是金属中最好的良导体。因它有极好的吸热、散热性能,故有许多超音速飞机的制动装置是用铍来制造的。当人造地球卫星和宇宙飞船穿上铍的“防热外套”时,能够及时吸收因穿越大气层摩擦而产生的热量并很快的散发出去,从而保障飞船的飞行安全。
铍还是高效率的火箭燃料,铍在燃烧时能释放出巨大的能量:每kg的铍完全燃烧放出的热量为62700kJ。
另外,几乎各种各样的原子反应堆都要用铍做中子反射体。要建设一个大型的原子反应堆,往往需要动用2吨金属铍。
(2)有些物质如B(OH)3(硼酸)、Al(OH)3中心原子是缺电子的,他们的最外层电子数都不满8个电子。在水中也有一定的酸性,但不是本身电离出H+,而是靠夺取水中的OH-使水电离出H+从而使溶液呈现酸性。如:
B(OH)3+H2O= B(OH)4-+H+ ;Al(OH)3+H2O= Al(OH)4-+H+
根据上述信息,请回答下列问题:
①铍的燃烧热是 。
②氧化铍、氢氧化铍性质类似于氧化铝、氢氧化铝,则氧化铍为 氧化物(填“酸性”或“碱性”或“两性”)。
③如果氢氧化铍与碱反应生成的阴离子中铍原子最外层电子数满足8电子结构,试写出氢氧化铍与氢氧化钠溶液反应的化学反应方程式: 。
④写出氧化铍与盐酸反应的离子反应方程式: 。
⑤能有效除去水中铍离子的试剂是: 。
A、氨水 B、碳酸钠溶液 C、稀硫酸 D、氢氧化钠溶液
26、(8分)对于可逆反应,达到平衡时,各生成物浓度以其计量数为指数幂的乘积与各反应物浓度以其计量数为指数幂的乘积之比为一常数,它只与温度有关,该常数叫做化学平衡常数,用K表示。
![]() 例如:对于aA+Bb mC+nD
例如:对于aA+Bb mC+nD
![]() K=———————— (其中[ ]表示物质的量浓度,固体的浓度为1。)
K=———————— (其中[ ]表示物质的量浓度,固体的浓度为1。)
![]() 反应Fe(固)+CO2(气)
FeO(固)+CO(气)的平衡常数为K1;反应
反应Fe(固)+CO2(气)
FeO(固)+CO(气)的平衡常数为K1;反应
![]() Fe(固)+H2O(气) FeO(固)+H2(气)的平衡常数为K2。在不同温度时K1、K2的值如下表:
Fe(固)+H2O(气) FeO(固)+H2(气)的平衡常数为K2。在不同温度时K1、K2的值如下表:
| 温度(绝对温度) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
![]() (1)推导反应CO2(气)+H2(气) CO(气)+H2O(气)的平衡常数K与K1、K2的关系式:
。
(1)推导反应CO2(气)+H2(气) CO(气)+H2O(气)的平衡常数K与K1、K2的关系式:
。
(2)计算K值:温度为973开时K= ;1173开时:K= 。通过K值的计算(1)反应是 反应(填“吸热”或“放热”)。
(3)在一体积为10L的密闭容器中,加入一定量的CO2和H2O(气),在1173开时发生反应并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
| 时间/min | CO2 | H2O | CO | H2 |
| 0 | 0.2000 | 0.3000 | 0 | 0 |
| 2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | |
| 5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
| 6 | 0.0350 | 0.1350 | 0.1650 |
①前2min,用CO表示的该化学反应的速率是: 。
②在3~4min之间,反应处于 状态(填“平衡”或“非平衡”)。
③第6min时,平衡向 方向移动,可能的原因是 。
五.(本题包括1小题,共10分)
27、相对分子质量不超过100的有机物 既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。 A完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。
①试A可能的结构简式: 。
②经核磁共振检测发现A的图谱如下:
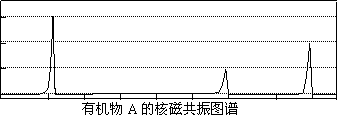 |
试写出A与甲醇反应生成有机物B的化学反应方程式:
。
③B在一定条件下可以反应生成有机玻璃,写出反应的方程式:
。
④B的同分异构体有多种,请写出三种和B同类别的同分异构体的结构简式:
。
六、(本题10分)(28题为分叉题,学生可任选一题做,若A、B都做,则以A题计分)
28(A)有机化学反应因反应条件不同,可生成不同的有机产品。例如:
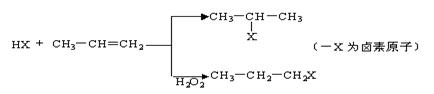 (1)
(1)
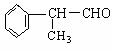 (2) 苯的同系物与卤素单质混合,在光照条件下,侧链上的氢原子被卤素原子取代;在催化剂的作用下,苯环上的氢原子被卤素原子取代。
(2) 苯的同系物与卤素单质混合,在光照条件下,侧链上的氢原子被卤素原子取代;在催化剂的作用下,苯环上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
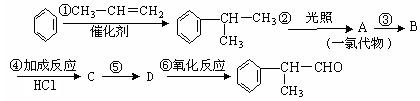
请根据上述路线,回答下列问题:
(1)A的结构简式可能为_______________________________________。
(2)反应③、⑤的反应类型分别为_________、_________。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
__________________________________________________________________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是__________________________________________________________________。
(5)这种香料是具有多种同分异构体,其中某种物质有下列性质:①该物质的水溶液遇FeCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述两条件的物质可能的结构简式。(只写两种)
__________________________________________________________________。
28(B)、A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有1个电子。
(1)C原子的电子排布式为 ,若A元素的原子最外层电子排布为1s1,则按原子轨道的重迭方式,A与C形成的化合物中的共价键属于 键。
 (2)当n=2时,B与A构成的分子为BA4,该分子的立体结构为_________,B与C形成的晶体属于 晶体。当n=3时,B与C形成的晶体中微粒间的作用力是
(2)当n=2时,B与A构成的分子为BA4,该分子的立体结构为_________,B与C形成的晶体属于 晶体。当n=3时,B与C形成的晶体中微粒间的作用力是
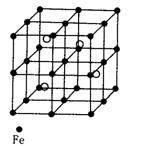
(3)若D元素与Fe形成某种晶体,该晶体的晶胞如右图所示。则,晶体的化学式__________________(用元素符号表示);若晶胞的边长为a nm,则合金的密度为________g/cm3。
二模参考答案
一、
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | A | B | D | D | A | A | B | C | B |
二、
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | AC | AC | BC | D | BC | A | BC | B | A | BD |
三、(30分)
21、(8分) (ⅰ)ACE(2分,漏选或错选给0分)
(ii)(1)蒸发皿(2分) (2)5.9或5.8 100mL 容量瓶(各2分)
22、(12分) (1)2.33g(1分);HgS(1分). (2) 第三周期,VIA族(1分) (3) 过滤、洗涤、干燥、称量(1分)
(4) SO2+Br2+2H2O=SO42-+2Br-+4H+ (2分); 3Ag+4H++NO3-=3Ag++NO↑+2H2O(2分)
(5)SO2气体通入过快,未被溴水完全吸收(1分) ;② 通入空气加热不充分(1分)
或加入BaCl2溶液没有过量,沉淀没有完全。
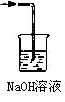 (2分,其中图1分,溶液1分)
(2分,其中图1分,溶液1分)
23、(10分)(1)① 中和滴定(2分)
②Na2CO3 (2分)
| 40x-24y=4.0(1分) | 40x-6y=4.0(1分) | 40x-6y<4.0(1分) |
(2)取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量为m1,剩余固体在580℃时继续加热至恒重,测得固体质量为m2,然后根据(4.0- m1 ) g,确定水的含量;根据(m1- m2) g确定氢氧化钙的质量,最后确定氢氧化钠的质量。(3分)
四、(30分)
24(12分)、(1)﹥;C(Na+)+C(H+)=2C(CO32-)+C(HCO3-)+C(OH-)
(2)8.0×10-9(2分)
(3)CO32-和HCO3-; 1:1
(4)先增大后又减小。CO32-+H+=HCO3-(2分);HCO3-+H+=CO2↑+H2O(2分)
(5)6
除标明分值之外,其余每空各1分。
25. (1)564.3KJ·mol-1 (2)两性
(3)Be(OH)2+2OH-=Be(OH)42- (4)BeO+2H+=Be2++H2O
(5)B (每空2分,共10分)
26(8分)(1)K=K1/K2
(2)0.62;1.29;吸热
(3)①v(CO)=0.0130mol·L-1·nin-1 ②平衡
③右或正反应;升高温度(或减少了H2的浓度)
每空各1分。
五、有机题(10分)
27.(10分) ①CH3CH=CHCOOH、CH2=CHCH2COOH、CH2=C(CH3)COOH(3分)
![]() ② CH2=C(CH3)COOH+CH3OH
CH2=C(CH3)COOCH3+H2O
② CH2=C(CH3)COOH+CH3OH
CH2=C(CH3)COOCH3+H2O
![]()
![]() CH3
CH3
![]()
![]()
![]()
![]() ③nCH2=C(CH3)COOCH3
[ CH2—C ]n
③nCH2=C(CH3)COOCH3
[ CH2—C ]n
COOCH3
④略(合理即可得分)(3分)
(除标明外,每空2分)
六、 (10分)
28(A).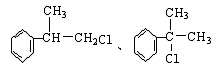
(1)(各1分)
(2)(各1分) 消去; 水解(或取代)
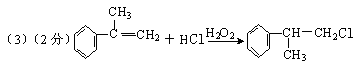
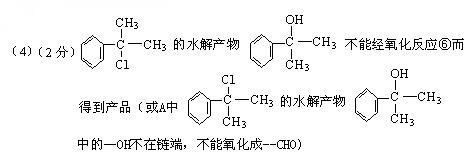
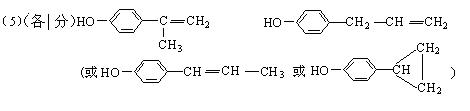
(其他合理答案均可给分)
28(B) (1)1s22s22p4(2分) σ(1分)
(2)正四面体形(1分) 分子(1分) 共价键或极性共价键(1分)
(3) Fe2Al (2分);5.56×10 23/a3NA (2分)