高三化学复习必修1过关测试
一、选择题(本题包括20小题,每题3分,共60分)
|
A.Cl2 + H2O ==== HCl + HClO B.2H2O ==== 2H2↑+ O2↑
C.2Na + 2H2O === 2NaOH + H2↑ D.CaO + H2O === Ca(OH)2
2. 下列说法中正确的是
A.含最高价元素的化合物,一定有强氧化性
B.阳离子只有氧化性,阴离子只有还原性
C.失电子多的还原剂,还原性强
D.化学反应,某元素由化合态变成游离态,此元素可能被氧化,也可能被还原
3.下列过程不发生氧化还原反应的是
A.Cl2溶于水 B.制漂白粉 C.实验室制CO2 D.实验室制Cl2
4、设阿佛加德罗常数为NA,下列叙述正确的是
A、1摩尔D2O所含质子数为12 NA B、10克氖气所含原子数为NA
C、0.5摩尔单质铝与足量盐酸反应转移电子数为1.5NA
D、标准状况下,1升水所含分子数为![]() NA
NA
5.在酸性溶液中下列各组离子可以大量共存的是
A.Al3+ 、NO3-、NH4+、AlO2- B.Na+、Fe2+、ClO-、K+
C.Mg2+、 K+、Na+、SO42- D.K+、Na+、HCO3-、SO42-
6.在氢氧化钾溶液中,已知钾离子与水分子的物质的量之比为a : b,溶液的密度为d g/cm3,则溶液的浓度为
|
7.向下列溶液中,通过量的CO2 ,溶液出现浑浊的是
A.澄清石灰水 B.CaCl2溶液 C. NaAlO2溶液 D. NaHCO3溶液
8.能用于区别两种棕黄色的液体FeCl3溶液和溴水的试剂是
A.Fe粉 B. KSCN C.H2O D. 淀粉KI溶液
9.把铁、铜、FeCl3、FeCl2和CuCl2溶液混在一起,铁有剩余,则溶液中所含最多的阳离子是
A.H+ B. Cu2+ C.Fe3+ D. Fe2+
10.在Al2(SO4)3、K2SO4和明矾的混合液中,如果SO42-的物质的量浓度为0.2 mol·L-1,当加入等体积的0.2 mol·L-1的KOH溶液时,生成的沉淀恰好溶解,则原混合物中K+的物质的量浓度是
A.0.2 mol·L-1 B.0.25 mol·L-1C.0.225mol·L-1D.0.45 mol·L-1
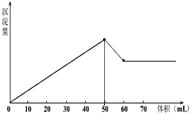
11.在Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原溶液中Al2(SO4)3和MgSO4的物质的量之比为
A、1 :2 B、3 : 1 C、3 : 2 D、2 : 1
12、.下列物质不能通过化合反应得到的物质是
A、CuCl2 B、FeCl2 C、FeS D、CuS
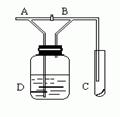 13、如图,A处通入Cl2,关闭B阀时,C处的红布看不到明显现象;当打开B阀后,C处红布条逐渐褪色。则D瓶中装的是
13、如图,A处通入Cl2,关闭B阀时,C处的红布看不到明显现象;当打开B阀后,C处红布条逐渐褪色。则D瓶中装的是
A、浓盐酸 B、NaOH溶液 C、H2O D、饱和NaCl溶液
14、下列离子方程式书写正确的是
A、在氯化铝溶液中加入过量氨水 Al3++3OH- =Al(OH)3↓
B、在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO42- = BaSO4↓
C、氯气和水反应 Cl2+H2O=2H++Cl-+ClO-
D、将过氧化钠投入水中,2Na2O2 + 2H2O === 4Na+ + O2↑ + 4OH-
15、据报道,1994年12月科学家发现了一种新元素,它的原子核内有161个中子,质量数为272,该元素的质子数为
A 、111 B、161 C、272 D、433
16.将0.2mol·L-1 Ba(OH)2溶液与0.05mol·L-1 NaHSO4溶液等体积混合后,下列几种离子浓度大小顺序正确的是
A.[Ba2+]>[OH-]>[SO42-]>[Na+] B.[Na+]>[OH-]>[Ba2+]>[SO42-]
C.[Na+]>[Ba2+]>[OH-]>[SO42-] D.[OH-]>[Ba2+]>[Na+]>[SO42-]
17、已知I-、Fe2+、SO2、Cl-、H2O2在酸性溶液中的还原性强弱顺序为:SO2 > I-> H2O2> Fe2+> Cl-,则下列反应不可能发生的是:
A、H2O2+ H2SO4= SO2+ O2+2 H2O B、2 I-+2 Fe3+= I2+ 2Fe2+
C、2 Fe3++ SO2 +2 H2O= 2Fe2++SO42-+4H+
D、SO2 +2 H2O+ I2= H2SO4+2HI
18、用NaOH固体,配制250mL0.5mol/LNaOH溶液,在下列仪器中选出正确的组合:①托盘天平、②量筒、③烧杯、④玻璃棒、⑤漏斗、⑥500mL容量瓶、⑦药匙、⑧250mL容量瓶、⑨胶头滴管、⑩坩埚
A.①③④⑥⑨⑩ B.①④⑦⑧⑨⑩ C.①③④⑦⑧⑨ D.①②④⑤⑧⑨
19、下列分离或提纯物质的方法正确的是
|
B、用溶解、过滤的方法提纯含少量BaSO4的BaCO3
C、用加热蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质
D、 去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
20、下列各组中的两种物质作用时,反应条件或反应物的用量改变时,对生成物没有影响的是
A、Na2O2 与CO2 B、NaOH与 CO2 C、Ca(OH)2与NaHCO3 D、Na与O2
二、填空题(本题共4个小题,共26分)
21、(5分)用20gNaOH配成250mL溶液,它的物质的量浓度为 。取出5mL该溶液,它的物质的量浓度为 ,再加水稀释至100mL,则稀释后溶液的物质的量浓度为 ,其中含NaOH的质量为 。该100mL溶液可以跟浓度为0.1mol/L的硫酸溶液 mL完全中和。
22、(10分)有一种溶液,其中含有Ag+、Al3+、K+、Mg2+。
(1)向溶液中加入氯化钠溶液,现象为 。反应的离子方程式 。
(2)将实验(1)所得溶液过滤,向滤液中加入过量氢氧化钠溶液,现象为
溶液中进行的反应的离子方程式 、 、
。
(3)将实验所得的溶液过滤,向滤液中加入过量的盐酸,产生的现象为 、
反应的离子方程式 、 、 。
23、(4分)某无色溶液可能由Na2CO3、 MgCl2、 NaHCO3、 BaCl2中的一种或几种混合而成。往溶液中加入烧碱溶液出现白色沉淀;加入稀H2SO4也出现白色沉淀,并放出气体。据此分析该溶液中一定有 ;可能有 。
24、(7分)根据下图的互变关系填空白(E为不溶于稀硝酸的白色沉淀,B为黄绿色气体)
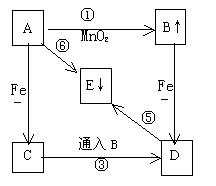
⑴写出下列物质的化学式
A 、C、 、D
⑵写出有关离子方程式(是氧化还原反应的标明电子转移,指出氧化剂、还原剂)
①
③ ,
三、实验题
25、(14分)“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
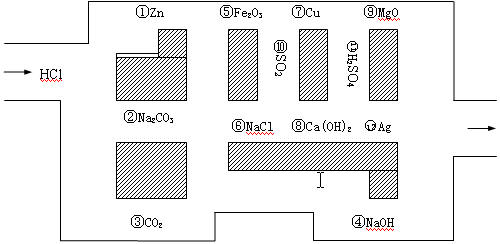
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有 个,
属于氧化还原反应的有 个,其中能“吃掉”盐酸的盐是 ,写出该反应的离子方程式
(3)在不能与盐酸反应的物质中,属于电解质的是 (填写物质序号),属于非电解质的是
(4)如果将盐酸换成浓硝酸,它能沿着盐酸走出的路线“走出”这个迷宫吗?为什么?
26.(选做题)(14分)小冬同学在家务劳动时跟爸爸学习杀鱼,在杀鱼时对从鱼腹内取出的鱼鳔产生了兴趣。他拟定“探究鱼鳔内气体的成分和体积”作为课题进行研究。
小冬查阅资料获知:这种鱼的鱼鳔内氧气占四分之一,其余气体是二氧化碳和氮气。
他设计了如下实验方案:
Ⅰ.测量鳔内气体的体积。小冬设计了两种方法:
(1)用医用注射器(带有准确的刻度)抽取鱼鳔内的气体,测量其体积;
(2)在水槽中倒扣一个盛满水的量筒,用镊子夹住鱼鳔,将鱼鳔尖端放在量筒口处,用一根针在水下刺破鱼鳔尖端,用排水集气法收集鳔内的气体并测量其体积。
你认为其中测量结果不准确的是 ,理由是
Ⅱ.探究鳔内气体的成分。小冬收集了鳔内气体分别装在集气瓶和医用注射器中进行如下实验。
| 实验编号 | 实验记录 | |
| (3)验证鳔内含有氧气 | 将燃着的木条放入集气瓶中 | 木条能继续燃烧,证明含有氧气 |
| (4)验证鳔内含二氧化碳 | 操作方法: | 实验现象: 该反应的离子方程式是: 该实验中能否使用上述(3)步实验结束后集气瓶中剩余的气体,为什么? 。 |
| (5)分离出氮气 | 取一份装在100mL医用注射器中的鳔内气体进行分离:第一步,将气体通过 (填试剂)除去氧气;第二步,将剩余气体通过足量的 除去二氧化碳;第三步,将剩余气体通过 1 进行干燥,即可得纯净的氮气。 |
第三步实验时还可以选用 作干燥剂。 |
参考答案
一、填空题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | D | C | C | C | D | C | B | D | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A | D | B | D | A | D | A | C | D | A |
二、填空题(本题共4个小题,共26分)
21、(5分)2mol/L、2mol/L、 0.1mol/L 0.4g 5m L
22、(10分)(1)产生白色沉淀 Ag+ + Cl¯== AgCl↓
(2)产生白色沉淀;沉淀达到最大量时,加入氢氧化钠沉淀部分溶解。
Mg2+ + 2OH¯== Mg(OH)2↓ Al3+ + 3OH¯== Al(OH)3↓ Al(OH)3 + OH¯== AlO2¯ + H2O
(3)开始加入盐酸无沉淀;后产生沉淀,沉淀达到最大量时,加入盐酸沉淀溶解,直至完全消失。H+ + OH¯== H2O 、AlO2¯ + H+ + H2O == Al(OH)3↓、Al(OH)3 + 3H+ == Al3+ + 3H2O
23、(4分)一定有BaCl2、 NaHCO3、可能有MgCl2 每个分子式2分
24、(7分)A、HCl C、FeCl2 D、FeCl3 每空2分
 |
MnO2 + 4H++2Cl¯ == Mn2+ + Cl2↑ +2 H2O 氧化剂:MnO2 还原剂:Cl-
2Fe2++Cl2 ==2Fe3+ +2Cl¯ 氧化剂:Cl2 还原剂:Fe2+
三、实验题
25、(1)3 、6 、10、7、11、12
(2)2 ,1,Na2CO3(1分),CO32-+2H+=CO2↑+H2O
(3)6、11 ,3、10
(4)不能,因为浓硝酸有强氧化性,遇到二氧化硫、铜和银时都会发生反应从而被“吃掉”。
26.(选做题)Ⅰ.(1)2 ,二氧化碳能溶于水,收集到的气体体积比实际体积小。Ⅱ.将注射器内的气体缓缓通入到盛有足量澄清石灰水的烧杯中
石灰水变浑浊 Ca2++2OH-=CaCO3↓+H2O 不能。因为木条燃烧时产生了二氧化碳。
灼热的铜 NaOH溶液 浓硫酸 碱石灰(或五氧化二磷或硅胶等)