高三化学上学期练习题
一、单项选择题(18×3=54分)
1.下列有关环境、健康、发展的叙述中,不正确的是:
A.可吸入颗粒(例如硅酸盐粉尘)在空气中形成气溶胶,对人类健康危害极大。
B.开发利用新能源,合理利用工业生产的废热,是缓解能源危机的重要途径。
C.氮的氧化物是光化学烟雾的主要污染物,二氧化碳是温室效应的主要污染物。所以它们的含量是空气质量报告的主要项目之一。
D.用二氧化硫漂白的食物白皙鲜嫩,且能防腐,但二氧化硫不可作食品添加剂。
2.在空气中长时间放置少量金属钠,最终产物是
A.Na2O B.NaOH C.Na2CO3 D.Na2O2
3.下列氯化物中,能直接利用金属与稀盐酸的反应得到的是
A.FeCl3 B.CuCl2 C.HgCl2 D.FeCl2
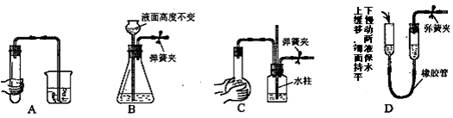 4.下列各图所示装置,肯定不符合气密性要求的是
4.下列各图所示装置,肯定不符合气密性要求的是
5.下列离子方程式表示正确的是
A.等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
B.向小苏打溶液中加入醋酸溶液:HCO3-+H+=CO2↑+H2O
C.氯化铁溶液中加入铜片:Fe3++Cu=Fe2++Cu2+
D.NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
6.甲、乙都是短周期元素,其中甲元素原子的最外层电子数是次外层电子数的2倍,乙元素原子K层
和M层电子数之和与L层的电子数相同。下列判断不正确的是
A.乙元素的族序数比甲元素的族序数大
B.乙元素最高价含氧酸酸性比甲元素最高价含氧酸酸性强
C.乙元素的原子序数比甲元素的原子序数大
D.含乙元素的化合物数目比含甲元素的化合物数目多
7.根据相关化学原理,下列判断正确的是
A.若X是原子晶体,Y是分子晶体,则熔点:X<Y
B.若A2十2D— ===2A— 十D2,则氧化性:D2> A2
C.若R2— 和M+的电子层结构相同,则原子序数:R>M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB
8.下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g)![]() 2H2O(g);△H=-483.6 kJ· mol—1,则氢气的燃烧热为241.8kJ
2H2O(g);△H=-483.6 kJ· mol—1,则氢气的燃烧热为241.8kJ
B.已知C(石墨,s)![]() C(金刚石,s);△H>0,则金刚石比石墨稳定
C(金刚石,s);△H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(ag)+HCl(aq)![]() NaCl(aq)+H2O(l);△H=-57.4 kJ· mol—1
NaCl(aq)+H2O(l);△H=-57.4 kJ· mol—1
D.己知2C(s)+2O2(g)=2CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2,则△H1>△H2
9.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中不正确的是
A.将162.5g FeCl3转化为氢氧化铁胶体后,氢氧化铁胶体粒子数小于6.02×1023
B.在含196g H2SO4的浓硫酸溶液中加入足量的锌粉使其充分反应,则反应结束时,转移电子数约为4×6.02×1023个
C.在石墨晶体中,平均0.3 mol碳碳共价键所含有的碳原子数约为0.2×6.02×1023
D.1mol C10H22分子中共价键总数约为31×6.02×1023
10.下列各组离子,在指定的环境中一定能大量共存的是
A.在pH为7的溶液中:Ag+、K+、SO42—、Cl—
B.在能使pH试纸变深蓝色的溶液中:Na+、S2—、NO3—、CO32—
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42—、NO3—、
D.在由水电离出的c(OH—)=10—13mol·L—1的溶液中:Na+、Fe3+、Cl—、I—
11.恒温下,容积均为2L的密闭容器M、N中,分别有以下列两种起始投料建立的可逆反应
3A(g) + 2B(g) ![]() 2C(g) + xD(s) 的化学平衡状态,相关数据如下:
2C(g) + xD(s) 的化学平衡状态,相关数据如下:
M:3molA 2molB; 2min达到平衡,生成D1.2mol,测得从反应开始到平衡C的速率0.3mol·L-1·min-1
N:2molC ymolD; 达到平衡时c(A)=0.6mol·L-1。
 下列推断的结论中不正确的是
下列推断的结论中不正确的是
A.x=2 B.平衡时M中c(A)=0.6mol·L-1
C.y﹥0.8 D.y﹤0.8
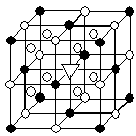
12. 冰晶石(化学式为Na3AlF6)的结构单元如右图所示,已知冰晶石熔融时电离方程式为Na3AlF6 =3Na+ + AlF6—
●位于大立方体顶点和面心
○位于大立方体的12条棱的中点和8个小立方体的体心
那么大立方体的体心处▽所代表的微粒是
A.Na+ B.Al3+
C.F— D.AlF6—
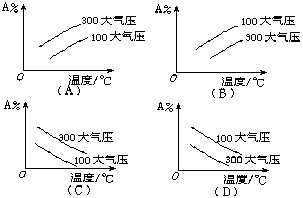
13.在可逆反应mA(g)+nB(g) ![]() pC(g)中,m、n、p为系数,且m+n>p,正反应是放热反应。分析下列各图,在平衡体系中A的质量分数与温度toC、压强P关系正确的是
pC(g)中,m、n、p为系数,且m+n>p,正反应是放热反应。分析下列各图,在平衡体系中A的质量分数与温度toC、压强P关系正确的是
14..恒温恒压下,在容积可变的密闭容器中发生反应:A(g) + B(g)![]() C(g)。若开始时通入1molA和1mol B,达到平衡后生成a mol C,则下列说法错误的是
C(g)。若开始时通入1molA和1mol B,达到平衡后生成a mol C,则下列说法错误的是
A.若开始通入3mol A和3mol B,达到平衡后将生成3a mol C
B.若开始通入x mol A、2mol B和1mol C,则达到平衡后密闭容器中不可能有3mol C,
C.若开始时通入4 mol A、2 mol B和1 mol C,达到平衡时,B的物质的量一定大于2mol
D.若开始时通入2molA、2 mol B和1 mol C,达到平衡后,再通入3 mol则再次到达平衡后,C的物质的量分数为a/(2-a)
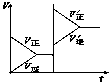 15..对于达平衡的可逆反应X+Y
15..对于达平衡的可逆反应X+Y![]() W+Z,增大压强则正、逆反应速率(v)的变化如图,分析可知X、Y、Z、W的聚集状态可能是
W+Z,增大压强则正、逆反应速率(v)的变化如图,分析可知X、Y、Z、W的聚集状态可能是
A. Z,W为气体,X,Y中之一为气体
B. Z,W中之一为气体,X,Y为非气体
C. X,Y,Z,W皆为气体
D. X,Y为气体,Z,W中之一为气体
16. 在一定温度下,向容积固定不变的密闭容器里充入amolNO2发生如下反应:2NO2(g)![]() N2O4(g),达到平衡后,再向该容器充入a mol NO2,达平衡后与原平衡比较正确的是
N2O4(g),达到平衡后,再向该容器充入a mol NO2,达平衡后与原平衡比较正确的是
A. 平均相对分子质量减小 B. NO2的转化率提高
C. 压强为原来的2倍 D. 颜色变浅
A17.将氨水逐滴加入到稀盐酸中,使溶液成中性,则此时
A.c(NH4+)==c(Cl-) B.c(NH4+)>c(Cl-)
C.c(NH4+)<c(Cl-) D.c(NH4+)与c(Cl-)之间关系不确定
18. 某温度下在密闭容器中发生如下反应:2M(g)+N(g)![]() 2E(g)。若开始时只充入2mol
2E(g)。若开始时只充入2mol
E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol M和1mol N 的混合气体,达平衡时M的转化率
A.20% B.40% C.60% D.80%
2007届武胜中学补习班
化学练习题
2006-12-18
姓名 班级
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
二.简答题
19. ⑴在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g)
![]() CO2(g)十H2
(g) (正反应放热),CO和H2O浓度变化如下左图,则
0—4min的平均反应速率v(CO)=_ 0.03 _ mol/(L·min)
CO2(g)十H2
(g) (正反应放热),CO和H2O浓度变化如下左图,则
0—4min的平均反应速率v(CO)=_ 0.03 _ mol/(L·min)
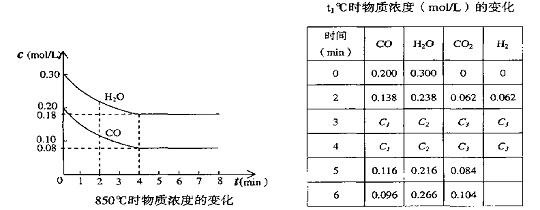
⑵t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min—4min之间反应处于平衡 状态;C1数值大于 0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min之间,平衡向逆方向移动,可能的原因是___ d ____ (单选);
表中5min—6min之间数值发生变化,可能的原因是__ a ________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
20.Ⅰ(4分)下列说法中,正确的有
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过三分之一的试管加热至沸腾
③硝酸、溴水可长期盛放在棕色的滴瓶中
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤熔融氢氧化钠要在耐高温的石英坩埚中
⑥将烧瓶放在桌上,再用力塞进塞子
Ⅱ(8分)某种胃药片的治酸剂主要成份为碳酸钙,某甲、乙两实验小组的同学测其所含碳酸钙的质量,均有如下操作:
① 配制0.10 mol·L-1 的盐酸和0.10 mol·L-1 的氢氧化钠溶液;
② 将一粒质量为0.2g的此胃药片,磨碎后加入20.00mL蒸馏水;
③ 以酚酞为指示剂,用0.10 mol·L-1 的氢氧化钠溶液滴定,达滴定终点时,消耗体积为V mL;
④ 加入25.00mL0.10mol·L-1 的盐酸溶液。
⑴ 甲组实验过程的步骤为①②④③,乙组实验过程的步骤为①②④③②④③,请根据你的实验经历判断谁更合理。 (填“甲”或“乙”)
⑵下图所示的仪器中配制0.10mol·L-1 盐酸溶液和0.10mol·L-1 氢氧化钠溶液肯定不需要的仪器是(填序号)____ ,配制上述溶液还需要的玻璃仪器是(填仪器名称) 。
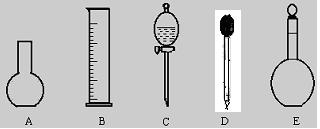
⑶配制上述溶液应选用的容量瓶的规格是(填字母)__________________。
①50mL、50mL ②100mL、100mL ③100mL、150mL ④250mL、250mL
21. (6分) 下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | | ||||||
| 2 | ‚ | ƒ | „ | … | |||
| 3 | † | ‡ | ˆ | ‰ |
(1)由上述元素形成的单质,熔沸点最低的是(写化学式,下同) ;形成的化合物可构成原子晶体的是 。
(2)列举事实用离子方程式说明⑨的非金属性强于⑧: 。
(3)除同族元素外,某些不同族元素的性质也有一定的相似性,如元素③与元素⑥的氢氧化物有相似的性质。试写出元素③的氢氧化物与NaOH溶液反应的化学方程式 。
22. (10分) A-G及X、Y均是中学化学常见物质,其中B、D、E、F、G在常温下为气体且B为红棕色, C的盐溶液通常为蓝色。它们之间有如下转化关系(其中反应③④⑦的产物中还有水):
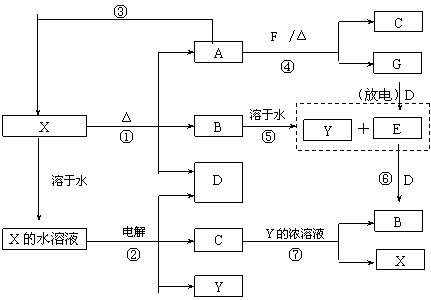 |
请回答下列问题:
⑴写出G分子的电子式: ;
⑵写出反应⑦的离子方程式是: ;
⑶写出电解X溶液的阳极反应式: ;
⑷写出反应④的化学方程式并标出电子转移情况: ;
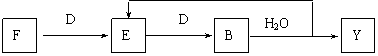 ⑸若使F按下列途径完全转化为Y:
⑸若使F按下列途径完全转化为Y:
则参加反应的F与整个过程中消耗D的物质的量之比为 。
23.(8分)I. 叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质。
(1)NaN3中存在的化学键有_ _(答案可能不止一个,填字母)。
a.离子键 b.极性共价键 c.非极性共价键
(2)3mol NaN3受撞击会生成4mol 氮气和一种离子化合物A,可用于汽车保护气囊。请写出有
关反应的化学方程式 ____ 。
Ⅱ.已知X、Y、Z、W是短周期中的四种非金属元素,它们的原子序数依次增大。X元素原
子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下
均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
⑴仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的
离子方程式为_ 。
⑵这四种元素可组成原子个数比为5:1:1:3的化合物(按X、Y、Z、W的顺序),该化合物的
水溶液与足量的NaOH溶液反应的离子方程式为: 。
24.(10分) 将2molSO2和1molO2混合置于一定体积、压强的密闭容器中,在一定温度下发生如下反应:
2SO2(g)+O2(g) ![]() 2SO3(g),△H < 0,当反应进行到时间t1点时达到平衡状态,测得混合气体总
2SO3(g),△H < 0,当反应进行到时间t1点时达到平衡状态,测得混合气体总
物质的量为2.1 mol。试回答下列问题:
(1)反应进行到t1时,SO2的体积分数为 。
(2)保持压强恒定,体积可变:
若在t1时充入一定量的氩气(Ar),SO2的物质的量将 (填“增大”、“减小”或“不变”);若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量将 2.1mol(填“<”、“>”或“=”),
(3)保持恒温恒容的条件下:
若在t1时充入一定量的氩气(Ar),SO2的物质的量将 (填“增大”、“减小”或“不变”);若在t1时再加入0.2molSO2、0.1molO2 和1.8molSO3,重新达到平衡状态时,SO2的转化率将(填“增大”、“减小”或“不变”)。
化学练习题
2006-12-18
1.C 2.C 3.D 4.D 5.A 6.D 7.D 8.C
9.B 10.B 11 D 12.A 13. B 14. C 15. D16.B17.A18.C
19. ⑴_ 0.03 _ mol/(L·min)
⑵①平衡 ;大于 。
②__ d _____(单选),
__ a ________(单选)。
20.(12分)
Ⅰ①④(对1个得2分,有错不给分,共4分)
Ⅱ⑴乙(2分) ⑵A、C(各1分) 玻璃棒、烧杯(各1分) ⑶②(2分)
21.(6分)(1)H2 (1分)(2)SiO2 (Si3N4、AlN)(1分,写出任一化学式都得1分)
(3) Cl2+S2-=2Cl-+S(2分) (其它答案合理也给分,但要是离子方程式)
(4)Be(OH)2+2NaOH === Na2BeO2+2H2O (2分)
22.(10分)(1)![]() (2分)
(2分)
(2)Cu+4H++2NO3-=Cu2++2NO2↑+2H2O (2分)
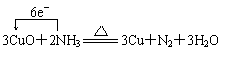 (3)4OH— —4e- =2H2O+O2↑ (或2H2O-4e-=4H++O2↑)(2分)
(3)4OH— —4e- =2H2O+O2↑ (或2H2O-4e-=4H++O2↑)(2分)
(4) (2分)
(5)1∶2(2分)
23.I. ⑴ a、c (2分)
(2)3NaN3 === Na3N +4N2↑(2分)
Ⅱ.⑴NH4++H2O![]() NH3·H2O+H+(2分)
NH3·H2O+H+(2分)
⑵NH4+ +HCO3-+2OH-==NH3↑+2H2O+CO32- (2分)
24.(10分)(1)9.5%(2分); (2)增大(2分),>(2分); (3)不变(2分);>(2分)。