高三化学上学期质量检测试卷
化 学 试 题
(满分:150分 考试时间:120分钟)
说明:
本试卷分第Ⅰ卷和第Ⅱ卷两部分,第Ⅰ卷4页为选择题,第Ⅱ卷6页为非选择题。
相对原子质量:
H | 1 | C | 12 | N | 14 | O | 16 | Na | 23 | ||
| Mg | 24 | S | 32 | Cl | 35.5 | Ca | 40 | Zn | 65 |
第Ⅰ卷(选择题 共66分)
注意事项:
1. 答卷前考生务必将自己的姓名、考生号、考试科目填写在规定的地方。
2. 每小题选出答案后用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后再选涂其他答案标号。不能答在第Ⅰ试卷上。
3. 考试结束后考生将答题卡和第Ⅱ卷一并交回。
一.选择题(本题包括22小题,每小题3分,共66分。每小题只有一个选项符合题意)
1.下列说法不符合人与自然和谐相处的是:
A.很多城市对废旧电池进行回收处理
B.许多国家对聚乙烯等塑料垃圾进行了深埋或者倾倒入海处理
C.现在不少地区正在使用沼气,太阳能,风能等能源替代传统的煤炭
D.许多地方政府出台相关法规来保护生物物种多样性
2.某些建筑材料中含有放射性元素氡(Rn)。下列有关氡的说法不正确的是
A.219Rn、220Rn、222Rn是氡元素的三种同位素
B.氡是双原子分子,在大气中有极少量存在
C.![]() 原子中的中子数与质子数之差为50
原子中的中子数与质子数之差为50
D.氡气因具有放射性而对人体有害
3.下列化学用语表示正确的是
![]() A.氯化钠的电子式
A.氯化钠的电子式
B.NaHCO3的电离方程式NaHCO3=Na++H++CO32—
C.乙醛的结构简式为CH3COH
D.氮气的结构式为N≡N
4.下列各物质的晶体中,晶体类型相同的是
A.O2和SiO2 B.NaI和I2 C.CCl4和NaCl D.CO2和H2O
5.下列有机物的名称正确的是
A.3—甲基丁烷 B.2—乙基丁烷
C.2,2,4.4—四甲基辛烷 D.1,1,3—三甲基戊烷
6.在一定条件下发生下列变化,其中不属于盐类水解反应的是
A.HS—+H2O![]() S2—+ H3O+ B.HCO3—+H2O
S2—+ H3O+ B.HCO3—+H2O![]() H2CO3+OH—
H2CO3+OH—
C.NH4++H2O![]() NH3·H2O+H+ D.AlO2—+2H2O
NH3·H2O+H+ D.AlO2—+2H2O![]() Al(OH)
3+OH—
Al(OH)
3+OH—
7.常温下,将乙酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中
A.c(CH3COO-)>c(Na+) B.c(CH3COO-)<c(Na+)
C.c(CH3COO-)=c(Na+) D.无法确定c(CH3COO-)与c(Na+)关系
8.在一定的温度下,往饱和NaOH溶液中加入一定量的Na2O2,充分反应后恢复到原温度,下列说法中正确的是
A.溶液中Na+浓度加大,有O2放出
B.溶液中的PH值不变,有O2放出
C.溶液中的Na+浓度减小,有O2放出
D.溶液的PH的值增大,有O2放出
9.某温度下的恒容密闭容器中发生如下反应:
2X(g)+Y(g)![]() 2Z(g)
2Z(g)
开始时只充入2.0 mol X和1.0 mol Y的混合气体,达到平衡时,混合气体的压强比开始时减少了20%。若开始只充入2.0 mol Z的气体,达到平衡时,Z的分解率为
A.20% B.40% C.60% D.80%
10.最近科学家们制出了首批氧一l8气体,18O是氧的一种稳定的核素,称为重氧。下列说法中正确的是
A.18O与16O是氧元素的两种同素异形体
B.0.1mol重氧水(H218O)中所含的中子数约为6.02×1023个
C.2mol18O2气体的体积约为44.8L
D.18O2气体的摩尔质量为36g
11.下列各组离子能大量共存的是
A.H+、Ba2+、Cl-、NO![]() B.ClO-、S2—、K+、Fe3+
B.ClO-、S2—、K+、Fe3+
C.Al3+、NO![]() 、AlO
、AlO![]() 、SO
、SO![]() D.NH4+、Na+、CO
D.NH4+、Na+、CO![]() 、OH—
、OH—
12.下列离子方程式中正确的是
A.氯化铁溶液与铁反应:Fe3+ + Fe = Fe2+
B.氯气与氢氧化钠溶液反应:2OH— + Cl2 = ClO— + Cl— + H2O
C.氯化铝溶液中加入过量氨水:Al3+ + 4NH3•H2O = AlO![]() + 4NH4+ +2H2O
+ 4NH4+ +2H2O
D.碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO![]() + OH- = CO
+ OH- = CO![]() + H2O
+ H2O
13.下列各组试剂在溶液中反应,因试剂的用量发生改变时,都可以用同一离子方程式表示的是
A.碳酸钠、稀盐酸 B.偏铝酸钠、盐酸
C.铁粉、稀硝酸 D.硫酸钠、氢氧化钡
14.将氯化亚铁溶液加热蒸干、灼烧后所得固体是
A.氯化亚铁 B.氢氧化亚铁 C.氧化铁 D.氧化亚铁
15.用已知浓度的NaOH溶液滴定待测浓度的盐酸(盐酸置于锥形瓶中),以下操作会造成所测盐酸溶液浓度偏高的是
A.酸式滴定管未用待装溶液润洗 B.碱式滴定管未用待装溶液润洗
C.锥形瓶未用待装溶液润洗 D.滴定后,俯视滴定管读数
16.下列说法正确的是
A.苯酚、硫氰化钾、乙酸、氢氧化钾四种溶液可用FeCl3溶液一次鉴别
B.CH3CH2OH、CH2=CHCOOH、CH3CHO、CH3COOH四种溶液可用新制Cu(OH)2
一次鉴别
C.除去KCl溶液中的少量MgCl2: 加入适量NaOH溶液,过滤
D.KCl溶液中混有少量KI,可通入足量Cl2后,再用乙醇进行萃取、分液
17.钢铁发生腐蚀时,负极上发生的反应为
A.Fe-3e—=Fe3+ B.Fe-2e—=Fe2+
C.2H2O+O2+4e—=4OH— D.4OH—-4e—=2H2O+O2↑
18、分子式为C5H12O的醇,其分子结构中有一个碳原子不跟氢原子直接相连,则该醇的分子结构可能有
A.2种 B.3种 C.4种 D.5种
19.用石墨作电极,电解1 mol·L–1下列物质的溶液,溶液的pH值保持不变的是
A.HCl B.NaOH C.Na2SO4 D.NaCl
20.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g )+3H2(g)![]() 2NH3(g),△H<0.673K、30Mpa下n(NH3)和n(H2)随时间变化的
2NH3(g),△H<0.673K、30Mpa下n(NH3)和n(H2)随时间变化的
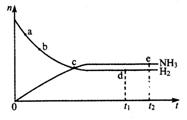 关系如图所示。下列叙述正确的是
关系如图所示。下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d (t1时刻)和点e (t2时刻)处n (N2)不一样
D.其他条件不变,773K下反应至t1时刻,
n(H2)比图中d点的值小
21.下列各组混合物无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的量是定值的是
A.CH2=CH2、C2H5OH、HOCH2CH2COOH
B.CH2O、C2H4O2、C6H12O6
C.C6H6、C5H12、C7H6O2
D.H2、CO、CH3OH
22.将一定量的锌与l00 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L测得溶液中pH=1, 则下列叙述中错误的是
A.气体 A 为 SO2 和 H2的混合物
B.气体 A 中 SO2 和 H2的体积比为 4∶l
C.反应中共消耗锌 97.5 g
D.反应中共转移电子3 mol
高三化学上学期质量检测试卷
化 学 试 题
注意事项:
1. 第Ⅱ卷共6页,用钢笔或圆珠笔直接答在试卷上。
2. 答卷前将密封线内的项目填写清楚。
| 题 号 | 第Ⅱ卷 | 总 分 | |||
| 二 | 三 | 四 | 五 | ||
| 得 分 | |||||
第Ⅱ卷 (非选择题 共84分)
二.(本题包括3小题,共22分)
23.(7分)某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→ MnSO4 + I2 + KIO3 + K2SO4 + H2O
①该反应的氧化剂是 ;氧化产物是 。
②如果该反应方程式中I2和KIO3的系数都是5,KMnO4的系数是 ,
若有I2和KIO3各5mol生成,则反应中转移的电子数为 mol。
③该方程式中I2和KIO3的系数若未作限定,可能的配平系数有许多组。
原因是: 。
24.(6分)在一容积为2.0L且容积不变的密闭容器中加入适量碳粉和0.20 mol H2O。
![]() 在800℃条件下,经20s后达到如下化学平衡(第一平衡):
在800℃条件下,经20s后达到如下化学平衡(第一平衡):
C(s) + H2O(g) ![]() CO(g) + H2(g);ΔH >0。已知平衡时,CO为0.12mol。试填空:
CO(g) + H2(g);ΔH >0。已知平衡时,CO为0.12mol。试填空:
(1)若用v(H2O)表示反应前20s内平均速率,则v(H2O)= 。
(2)若在上述平衡混合物中加入少量Na2O固体,并在此温度下再次达到新平衡(第二平
衡),则平衡时H2的物质的量 (填“增大”“减小”或“不变”)。
理由是 。
(3)若向上述第一平衡的混合物中,再充入a mol H2(a < 0.12),在相同条件下达到新的
平衡(第三平衡),此时,CO的物质的量n的取值范围是 。
25.(9分)向现有下列电解质溶液:① Na2CO3 ② NaHCO3 ③ CH3COONa
④ ![]() -ONa ⑤NaOH (用每种物质相应的序号填空)
-ONa ⑤NaOH (用每种物质相应的序号填空)
(1)在五种电解质溶液中,加入AlCl3溶液有气体产生的是
写出②与AlCl3反应的离子方程式 。
(2)若上述五种溶液的物质的量浓度均为0.2mol·L-1,将它们稀释相同倍数时,其pH变化最大的是 。
(3)当五种溶液的物质的量浓度相同时,其pH值由大到小的顺序是(填序号):
。

三.(本题包括2小题,共16分)
26.(3分)判断下列实验操作或对实验事实的叙述中正确的是
A.用托盘天平称取10.50 g干燥的NaCl固体。
B.中和热的测定所需的玻璃仪器只有烧杯、量筒。
C.采取降温结晶可以提纯混有少量氯化钾的硝酸钾。
D.测定烧杯中溶液的pH时,用pH试纸直接在烧杯中蘸取溶液。
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌。
F.实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
G.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
27.(13分)某学生利用以下装置探究氯气与氨气之间的反应。其中A,F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
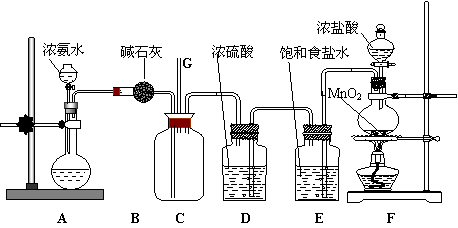 |
请回答下列问题:
(1)装置F中发生反应的离子方程式为
(2)装置A中的烧瓶内固体可以选用 (选填以下选项的代号)。
A.生石灰 B.二氧化硅 C.五氧化二磷 D.烧碱
(3)B装置的作用 ;E装置的作用 ;
(4)通入C装置的两根导管左边更长、右边更短,原因是
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?

四.(本题包括3小题,共30分)
28.(12分)A、B、C、D、E、F均为短周期元素,原子序数依次递增。A元素原子核内无中子。B元素原子核外最外层电子数是次外层电子数的2倍。C元素是地壳里含量最多的元素。D是短周期元素中金属性最强的元素。E与F的位置相邻,F的最高价氧化物的水化物为最强酸。
(1)推断B在元素周期表中的位置:第 周期, 族。
(2)画出F的原子结构示意图: 。
(3)C、D可形成淡黄色的粉末,其电子式为: 。
(4)写出A与C形成的10电子微粒的化学式: 、 、 。
(5)D、E形成的正盐的水溶液中,阴离子的浓度大小顺序为:
(从大到小排列) 。
(6)常温下,1mol A元素的单质与C元素的单质化合,放出286kJ的热,写出反应的
热化学方程式: 。
29.(12分)一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。
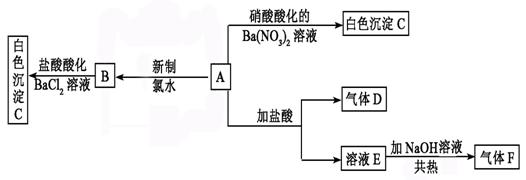
其中A为正盐,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。
试回答下列问题:
(1)写出下列物质化学式:
A:________________ _ C:____ _ ____________
(2)写出气体F的电子式 ,其分子空间构型为
(3)写出下列反应的离子方程式:
①E→F: 。
②A→B: 。
(4)在检验SO42—时,当确定溶液中不含 等干扰离子存在时可选用盐酸酸化的BaCl2溶液作试剂检验SO42—;在确定溶液中不含 等干扰离子存在时可选用HNO3酸化的Ba(NO3)2溶液作试剂检验SO42—。
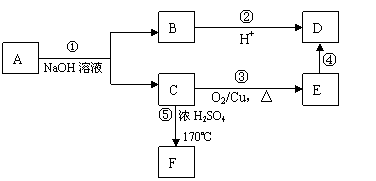 30.(12分)有机物A、B、C、D、E、F有如下转化关系。
30.(12分)有机物A、B、C、D、E、F有如下转化关系。
其中F的产量是衡量一个国家石油化工水平的标志,F还对水果有催熟作用。回答下列问题:
(1)D物质具有官能团的名称为 ;
①、⑤的反应类型分别是 、 。
(2)反应①的化学方程式为 。
反应③的化学方程式为 。
(3)写出与A物质同类的A的所有同分异构体的结构简式:
。

五.(本题包括1小题,共10分)
31. (10分)将0.05mol·L-1的盐酸与未知浓度的NaOH溶液以1∶2的体积比混合。(假设两溶液混合后体积不变)
计算:
(1)若所得溶液pH值为7,则NaOH溶液的物质的量浓度为
(2)若所得溶液pH值为2,则NaOH溶液的物质的量浓度为
(3)若用0.01 mol·L-1NaOH溶液与某一元弱酸HA 20.0 mL反应,恰好中和时消耗NaOH溶液10.0 mL,所得溶液pH值为10。求所得NaA溶液中A—离子的物质的量。
(设两溶液混合后体积不变)(本小题请写出计算过程)
高三质量检测
参考答案及评分标准
说明:化学方程式中,化学式写错的不给分;化学式对而未配平或条件有误的扣一半分;气体或沉淀符号未标不扣分。
一.(每小题3分,共66分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | B | B | D | D | C | A | C | B | B | B | A |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | B | D | C | B | A | B | A | C | A | A | B |
二.(本题包括3小题,共22分)
23.(7分)①KMnO4 ;I2、KIO3 (各1分,共3分) ② 8(2分) 40(1分)
③该反应式含两种氧化产物,两者的比例和氧化剂的用量都可以发生变化(1分)
24.(6分)(1)0.0030mol / (L•S)(2分)
(2)减小;(1分)
Na2O 与H2O 反应,使水蒸气浓度降低,平衡向左移动。(1分)
(3)(0.12 — a)mol< n < 0.12mol (2分)
25. (9分)(1)①②(2分)
3HCO3—+Al3+==Al(OH)3↓+3CO2↑(3分)
(2)⑤ (2分) (3)⑤①④②③(2分)
三.(本题包括2小题,共16分)
|
27.(13分)(1)MnO2+4H++2Cl-=Cl2↑+Mn2++2H2O(3分)
(2)A、D(2分)
(3)干燥氨气(1分) 除去氯气中的氯化氢(1分)
(4)因为氨气的密度小,氯气的密度更大,这样便于两种气体充分接触而反应。(2分)
(5)8NH3+3Cl2 ==6NH4Cl+N2 (3分)
(6)将尾气通入NaOH溶液中。(1分)
四.(本题包括3小题,共36分)
![]() 28.(12分)(1)二 IV A (2分);
28.(12分)(1)二 IV A (2分);
(2) (1分);
(3)![]() (1分); (4)H2O、H3O+、OH- (3分);
(1分); (4)H2O、H3O+、OH- (3分);
(5)c(S2-)>c(OH-)>c(HS-) (2分);
(6)H2(g)+ O2(g)= H2O(l);△H= —286kJ·mol-1(3分)
29. (12分)(1)(NH4)2SO3(1分) BaSO4(1分)
|
|
②Cl2+H2O+SO![]() ====SO
====SO![]() +2H++2Cl- (3分)
+2H++2Cl- (3分)
(4)Ag+ SO![]() (各1分)
(各1分)
30.(12分)(1)羧基; 取代反应、消去反应 (各1分,共3分)
|
![]() 2CH3CH2OH
+ O2
2CH3CHO + 2H2O (3分)
2CH3CH2OH
+ O2
2CH3CHO + 2H2O (3分)
(3)CH3CH2COOCH3、HCOOCH2CH2CH3、HCOOCH(CH3)2 (各1分,共3分)
31.(10分)
(1)0.025 mol·L-1 (3分)
(2)0.01 mol·L-1 (3分)
(3)A- + H2O ![]() HA+OH―
HA+OH―
发生水解的A- 物质的量为:1×10-4 mol·L-1×0.03L(1分)
NaA总物质的量为:0.01 mol·L-1×0.01L(1分)
NaA溶液中A- = (0.01mol·L-1×0.01L)-(1×10-4 mol·L-1×0.03L)
=9.7×10-5 mol (2分)
或用电荷守恒:
n (Na+) + n (H+)=n (OH—) + n (A—)
0.01mol·L-1×0.01L+1×10-10 mol·L-1×0.03L=1×10-4 mol·L-1×0.03L+ n (A—)
n (A—)= 9.7×10-5 mol(4分)