高三化学下学期第六次月考试题
化 学 试 题
本卷可能用到的相对原子质量:H:1 He:4 C:12 N:14 O:16 Na:23
Mg:24 Al:27 Fe:56
一、选择题:(每小题3分,只有一个选项正确,共48分)
1、禽流感病毒对常用消毒剂十分敏感,容易将其杀灭,如氧化剂、稀酸等都能迅速破坏其活性,下列不能杀灭禽流感病毒的物质是( )
A、H2O2溶液 B、NaClO溶液 C、矿泉水 D、醋酸
2、已知NH3难溶于CCl4,如图所示,下列装置中,不宜于NH3气体尾气吸收的是( )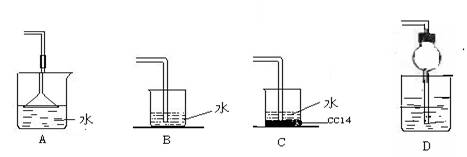
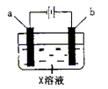
3、用两根石墨电极分别插入盛有氯化铜溶液的U形管中,接通电源,则关于与电源正极相连的电极描述正确的是(
)
A、阳极:有Cl2放出 B、阴极:有H2放出
 C、阳极:有O2放出 D、阴极:有Cu放出
C、阳极:有O2放出 D、阴极:有Cu放出
![]() 4、下列表达式方式中错误的是( )
4、下列表达式方式中错误的是( )
A、氯化氢分子的电子式:H+ [: :]- B、S2-的结构示意图:
C、O—18的原子符号:![]() D、CO2分子的结构式:O=C=O
D、CO2分子的结构式:O=C=O
5、在下列变化过程中,既有离子键破坏又有共价键破坏的是( )
A、将SO2通入水中 B、烧碱溶于水 C、将HCl通入水中 D、硫酸氢钠溶于水
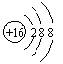
6、2006年10月16日,美国劳伦斯·利费莫尔国家实验室宣布,美、俄科学家合作,用大量Ca-48离子轰击人造元素锎—249,合成了3个新原子![]() ,其存在时间只有0.9毫秒,下列有关
,其存在时间只有0.9毫秒,下列有关![]() 的说法不正确的是( )
的说法不正确的是( )
A、科学家合成了一种新元素 B、该元素X位于第七周期
C、该元素X属于过渡元素 D、![]() 的中子数比电子数多61
的中子数比电子数多61
7、下列八种试剂中:①酚酞试液 ②银氨溶液 ③稀H2SO4 ④Na2SO3溶液 ⑤FeCl3溶液(加少量盐酸)⑥氢硫酸 ⑦Na2CO3溶液 ⑧石灰水 都不宜长期放置的组合是( )
A、②④⑥⑧ B、①②④⑥⑧ C、②③⑤⑦ D、②④⑤
![]() 8、实验室用4mol/LSO2和2molO2进行下列反应:2SO2(g)+O2(g) 2SO3(g);
8、实验室用4mol/LSO2和2molO2进行下列反应:2SO2(g)+O2(g) 2SO3(g);
△H= - 196.64KJ/mol,当放出314.624KJ热量时,SO2的转化率为( )
A、40% B、50% C、80% D、90%
9、下列反应的离子方程式正确的是( )
①硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
②将金属钠加入水中:2Na+2H2O=2Na++2OH-+H2↑
③石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
④铁粉与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
⑤小苏打溶液中加入少量的石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
⑥次氯酸钙溶液中通入过量的二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
⑦钠与硫酸铜溶液反应:Cu2++2Na=2Na++Cu
⑧氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
⑨纯碱溶液中滴加少量盐酸:CO32-+H+=HCO3-
A、①②⑤⑨ B、②③⑤⑨ C、④⑤⑥⑦ D、②③⑧⑨
10、设NA代表阿伏加德罗常数,下列说法正确的是( )
A、5.6g Fe与足量盐酸反应转移的电子数为0.3NA
B、100mL2.0mol/L的盐酸与100mL2.0mol/L的醋酸溶液中氢离子均为0.2NA
C、标准状况下,22.4L的氦气与22.4L氟气所含原子数均为2NA
D、20g重水(D2O)中含有的电子数为10NA
11、实验室需80mL1mol/L的NaOH溶液,若用固体NaOH配制,则应称取NaOH的质量为( )
A、3.2g B、4.0g C、4.8g D、19.2g
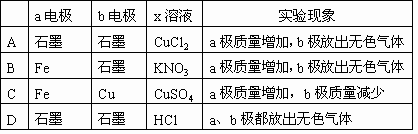
12、下列对如图所示装置实验现象的描述正确的是(
)
13、碘元素有多种价态,可以形成多种含氧阴离子IxOyn-,由2个IO62-正八面体共用一个面形成的IxOyn-的化学式为( )
A、I4O94- B、I2O46- C、I2O118- D、I2O1210-
14、下列实验基本操作中正确的是( )
A、用量筒量取液体时,视线与量筒内液体凹液面最低处保持水平
B、稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的量筒中并搅拌
C、用胶头滴管向试管中加入液体时,胶头滴管紧贴试管内壁
D、用托盘天平称量物质时,称量物放在右盘,砝码放在左盘
![]() 15、一定温度下,在恒容密闭容器中发生下列反应:2A(g)+B(g) 3C(g),若反应开始时充入2molA和1.5molC,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数仍为a%的是( )
15、一定温度下,在恒容密闭容器中发生下列反应:2A(g)+B(g) 3C(g),若反应开始时充入2molA和1.5molC,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数仍为a%的是( )
A.2molA B.1molB和1molC C.2molA、1molB和1molC D.3molA和0.5molB
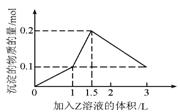 16、1L某混合溶液中,溶质X、Y的浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.1mol的NaOH或硫酸溶液),所得沉淀的物质的量随着Z溶液的体积变化如右图所示,则X、Y 、Z分别是( )
16、1L某混合溶液中,溶质X、Y的浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.1mol的NaOH或硫酸溶液),所得沉淀的物质的量随着Z溶液的体积变化如右图所示,则X、Y 、Z分别是( )
A.氯化铝、氯化铁、氢氧化钠
B.氯化铝、氯化镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸
D.偏铝酸钠、氯化钡、硫酸
17、(3分)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是反应产物之一。
(1)该反应中还原剂是_____________;(2)该反应中还原产物是_______________;(3)若反应过程中转移了0.3mol电子,则生成水的质量是________________________.
18、(4分)常温下将0.010molCH3COONa和0.004molHCl溶于水,配成0.5L混合溶液.判断:
(1)溶液中共有__________种粒子.
(2)溶液中有两种粒子的物质的量之和一定等于0.010mol,它们是_______________.
(3)溶液中n(CH3COO-)+n(OH-)- n(H+)=___________mol.
19、(9分)已知X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X_________Z__________
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为__________________、___________________、___________________
(3)由X、Y、Z所形成的常见离子化合物是___________,它与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式
_______________________________________________
(4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,不能形成的晶体类型是_________.
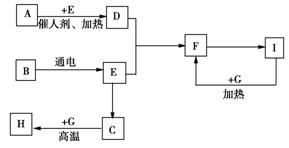 20、(4分)下图是中学化学中常见物质间的反应转化关系,其中部分产物已略去。常温下,G为固体单质,B、I为液体,其余都为气体。A为化合物,I的浓溶液与G在加热条件下生成F、B和C,H可用作工业上冶炼金属的还原剂。
20、(4分)下图是中学化学中常见物质间的反应转化关系,其中部分产物已略去。常温下,G为固体单质,B、I为液体,其余都为气体。A为化合物,I的浓溶液与G在加热条件下生成F、B和C,H可用作工业上冶炼金属的还原剂。
(1)写出下列物质的化学式:
A______________,C____________
(2)写出A→D的化学方程式:
___________________________。
(3)写出G和I的浓溶液反应的化学方程式______________________________________。
21、(6分)在有关定量实验中,采用下列操作会导致实验结果偏低的是________(填代号)
A.中和热测定实验中以环形铁丝搅拌棒代替环形玻璃搅拌棒
 B.配制100mL2mol/L的NaCl溶液,以胶头滴管加水定容时,液面稍超出容量瓶刻度线,反复摇匀后,凹液面最低点恰好与刻度线平齐
B.配制100mL2mol/L的NaCl溶液,以胶头滴管加水定容时,液面稍超出容量瓶刻度线,反复摇匀后,凹液面最低点恰好与刻度线平齐
C.测定硫酸铜晶体中结晶水含量,加热搅拌时,有少量固体溅出
D.称取一定质量无水碳酸钠粉末,用稀盐酸滴定(用甲基橙作指示剂),测定盐酸浓度.酸式滴定管用蒸馏水润洗后未用待装液润洗,立即装液、滴定
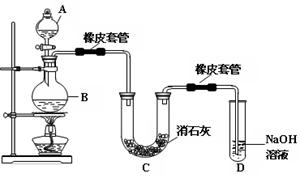
22、(14分)某学生设计下列实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
(1)A仪器的名称是 ,所盛试剂是 。
(2)漂白粉将在U形管中产生,其化学方程式是 。
(3)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 。
②试判断另一个副反应(写出此反应方程式): 。
为避免此副反应的发生,可采取的措施是 。
23、(6分)将ag金属钠投入到b g水中(1)所得溶液中溶质的质量分数为___________(用含a b的代数式表示,下同)
(2)能否求溶液物质的量浓度?为什么?__________________________________________
(3)所得溶液中Na+与H2O的个数比为_____________________________.
24.(6分)将51 g镁铝合金溶于60mL5.0mol/L的H2SO4溶液中,完全溶解后再加入65mL10.0mol/L的NaOH溶液,得到沉淀的质量为9.7 g,继续滴加NaOH溶液时沉淀会减少.
(1)当加入_______________mLNaOH溶液时,可使溶液在硫酸中的Mg和Al恰好完全沉淀.
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积________________.
化学试题参考答案:
1-5:CBAAD 6-10:CACBD 11-16:BCAAAC
17、(1)H2S (2)NO (3)3.6
18. (1)7 (2)CH3COOH、 CH3COO- (3)0.006
19. (1)H O
(2)![]() (共3分)氮化钠氢化钠也对
(共3分)氮化钠氢化钠也对
(3) NH4NO3 NH![]() +OH―
+OH―![]() NH3↑+H2O (4分)
NH3↑+H2O (4分)
(4)原子晶体 (2分)
20、(1)NH3 CO![]() (2)4NH
(2)4NH![]() +5H
+5H![]() O
O![]() 4NO+6H
4NO+6H![]() O
O
(3)C+4HNO![]() (浓)
(浓)![]() CO
CO![]() ↑+4NO
↑+4NO![]() ↑+2H
↑+2H![]() O
O
21.ABD
22.(1)分液漏斗;浓盐酸
(2)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(3)①将U型管置于冷水浴中
②Ca(OH)2+2HCl=CaCl2+2H2O;在BC之间连接一个盛有饱和食盐水的洗气瓶
23.(1)![]() (2)否;因不能求出溶液体积
(3)
(2)否;因不能求出溶液体积
(3) ![]() :(
:(![]() -
-![]() )
)
24.(1)60
(2)5.6L
略解:设合金中Mg Al的物质的量分别为x、ymol
则24x+27y=5.1 ①
当加入的OH-与原来H2SO4溶液中的H+的物质的量相等时,Mg2+、Al3+恰好反应完全,此时加入的NaOH溶液的体积为60![]() 10-3
10-3![]() 5.0×2
5.0×2![]() 10=0.06L=60mL,再多加5mLNaOH溶液所溶解的Al(OH)3时质量为5×10-3×10×78=3.9g,即沉淀的最大值为3.9+9.7=13.6g
10=0.06L=60mL,再多加5mLNaOH溶液所溶解的Al(OH)3时质量为5×10-3×10×78=3.9g,即沉淀的最大值为3.9+9.7=13.6g
故有58×x+78×y=13.6 ②
由①②得:x=0.1mol y=0.1mol
故产生H2的体积为0.1×22.4+0.1×![]() ×22.4=5.6L
×22.4=5.6L