高三化学二月月考试卷
命题:刘金荣 审题:张祖国
1、 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 Cl 35.5 Fe 56
2、 考试时间:120分钟。
3、 请将选择题答案填到第Ⅱ卷的答题卡上。
第Ⅰ卷 (选择题 共46分)
一、选择题(本题包括23小题,每小题2分,共46分,每小题只有一个选项符合题意)
1.据日本气象报道,2004年的臭氧空洞比往年小,即使在应该最大的9月份,臭氧空洞面 积也仅相当于南极大陆的1.5倍,2004年臭氧空洞的减小是自上个世纪90年代以来首次出现的现象。下列有关臭氧的说法中正确的是
A.弥补臭氧空洞的最好方法是工业化制取臭氧,再释放到太空中
B.臭氧空洞的逐渐减小,与目前人们减少或不再使用氟氯代烃有关
C.臭氧和氧气互为同分异构体
D.臭氧空洞的减小主要是因为部分臭氧转化成氧气
2.下列物质均有漂白作用,但其中一种与其它三种的漂白原理不同的是
A. Na2O2 B. HClO
C. O3 D. SO2
3.在实验室,需储存在棕色试剂瓶中的药品是
A.浓盐酸 B.浓硫酸
C.浓硝酸 D.硅酸钠溶液
4.碱金属与卤素所形成的化合物在都具有的性质是
①高沸点 ②能溶于水 ③水溶液能导电 ④低熔点 ⑤熔融状态不导电
A.①②③ B.③④⑤ C.①④⑤ D.②③⑤
5.下列关于二氧化硫性质的叙述中,错误的是
A.二氧化硫能漂白某些物质,说明它具有氧化性
B.二氧化硫的水溶液能使紫色石蕊试液变红,说明它能和水反应生成H2SO3
C.将足量二氧化硫通入酸性高锰酸钾试液中,溶液褪色,说明二氧化硫具有还原性
D.实验室可用浓硫酸干燥二氧化硫
6.某蓄电池放电和充电时的反应为: Fe + Ni2O3 +3H2O -----→ Fe(OH)2 + 2Ni(OH)2
下列推断中正确的是
①、放电时Fe为正极, Ni2O3为负极;
②、充电时阴极上的电极反应式为: Fe(OH)2+2e- = Fe + 2OH-
③、充电时Ni(OH)2为阳极;
④、蓄电池的电极必须是浸在某种碱性电解质溶液中;
A.①②③ B.①②④
C.①③④ D.②③④
7. A、B、C、D四个集气瓶中分别盛有Cl2、H2、HCl、HBr中的一种,A 和D混合后见光爆炸,A 和B混合后瓶壁上有棕红色小液滴析出,则C 瓶所盛气体是
A.HCl B.Cl2
C.H2 D.HBr
8.下列单质中,最难与H2化合的是
A.Cl2 B.C
C.N2 D.O2
9.北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的球碳盐K3C60。实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构的分析中正确的是
A.K3C60中既有离子键,又有极性键
B.1 molK3C60中含有的离子数目为63×6.02×1023
C.该晶体在熔融状态下能导电
D.该物质的化学式可写为KC20
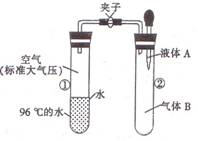 10.如图所示,夹子开始处于关闭状态,将液体A滴人试
10.如图所示,夹子开始处于关闭状态,将液体A滴人试
管②与气体B充分反应,打开夹子,可发现试管①内
的水立刻沸腾了。则液体A和气体B的组合不可能
是下列的
A.氢氧化钠溶液、二氧化碳
B.水、氨气
C.氢氧化钠溶液、一氧化氮
D.水、二氧化氮
11.常温下四只容积相同的抽空的密闭容器,分别注入下列各气体(先注入一种然后再注入另一种),全部气体注入完毕后,容器内压强从大到小的顺序是
①2molH2和1molO2 ②2molH2S和1molSO2
③2molNO和1molO2 ④2molNH3和1molHCl
A.①=②=③=④ B.①>③>④>②
C. ③>④>②=① D.①>②=③>④
12.下列离子方程式书写不正确的是
A.二氧化硅溶于氢氧化钠溶液:SiO2+2OH-===SiO![]() +H2O
+H2O
B.硫酸亚铁溶于稀硝酸:3Fe2++NO![]() +4H+===3Fe3++NO↑+2H2O
+4H+===3Fe3++NO↑+2H2O
C.亚硫酸钠溶液与双氧水混合:SO![]() +2H2O2===SO
+2H2O2===SO![]() +2H2O+O2↑
+2H2O+O2↑
D.亚硫酸铵溶液与氢氧化钡溶液混合:SO![]() +2NH
+2NH![]() +Ba2++2OH-===BaSO3↓+2NH3·H2O
+Ba2++2OH-===BaSO3↓+2NH3·H2O
13.锌与某浓度的硝酸完全反应,消耗的Zn与HNO3的物质的量之比为5:12,若还原产物只有一种,则其为
A.N2 B.N2O C.NO D.NO2
14.由CO和CO2组成的混合气体,经分析测知含氧的质量分数为70%,则应该混合气体中CO和CO2的体积比为
A.1 :3 B.3 :1
C.7: 33 D.7:11
15.15mL NO2和NH3的混合气体在一定条件下发生反应:6NO2 + 8NH3 = 7N2 + 12H2O 已知参加反应的NH3比NO2多1mL.则原混合气体中NO2与NH3的体积比为
A.3:4 B.3:5
C.5:7 D.1:4或11:4
16.已知25%和5%的两种氨水的密度分别0.91g/cm3和0.98g/cm3,若将上述两种氨水等体积混合,所得氨水的质量分数为
A.等于15% B.大于15% C.小于15% D.无法判断
17.下列离子组中,能大量共存的是
A. H+、Fe2+、SO42-、NO3- B.K+、NO3-、OH-、S2-
C. H+、K+、 NO3-、I- D.Na+、Al3+、SO42-、AlO2-
18.在一个2L的密闭容器中发生 3X(g)+Y(g)== Z(g)+2W(g)的可逆反应,5min时Y减少了0.1mol,则此段时间的平均速率为
A.VA=0.03mol/L.min B.VY=0.02 mol/L.min
C.VZ=0.10 mol/L.min D.Vw=0.20 mol/L.min
19.一定量稀硫酸溶液与过量铁粉反应,为减缓反应速率但又不减少生成的氢气总量,可以向稀硫酸中加入适量的
A.NaHCO3固体 B. CH3COONa固体
C.NaHSO4溶液 D.KNO3溶液
20.在一个5L的密闭容器中充入2molA和1molB,在一定条件下发生可逆反应:
2A(g)+B(g)==x C(g)+2D(g),4min后达到平衡,测得C的物质的量浓度为
0.1mol/L,反应速率为VD=0.025mol/L.min则下列说法错误的是
A. X=2 B. B的转化率为50%
C.VA=0.025mol/L.min D. 反应前后压强之比为12 :13
21.在一定条件下向一容积固定的密闭容器中充入3molA和1molB,发生可逆反应:
3A(g)+B(g)==x C(g),达平衡时,VC%为w%.若维持相同的反应条件,起始时向同一容器中充入的是1.2molA,0.4molB和1.2molC,反应达平衡时VC%仍为w%.则X值
A.只能是2 B.只能是4
C.可能是3 D.可能是2或4
22.在常温下,在10mLPH为10的Ba(OH)2溶液中加入PH=4的一元酸HA至溶液的PH值刚好等于7(设反应后溶液的体积为两溶液体积之和).则下列说法中正确的是
A. CBa2+=CA- B. CH+ = COH- <CA- <CBa2+
C. V总≤20mL D. V总≥20mL
23若已知分子组成为C5H12O的属于饱和一元醇的同分异构体有8种,则分子组成为C5H10O的属于饱和一元醛的同分异构数目
A.也是8种 B.少于8种
C.多于8种 D.无法判断
第Ⅰ卷答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 1 | 1 | 1 | 1 | 4 | 5 | 6 | 7 | 8 | 9 | 2 | 2 | 2 | 2 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷 ( 非选择题 共54 分)
二、(本题包括6小题,共42分)
24.(2分)在一个密闭容器中充入NO2气体,发生反应:
2NO2(g) ==N2O4(g) ΔH<0,达到平衡后,在t1时刻,改
变某一反应条件,反应速率变化如图所示, 则t1时刻改
变的反应条件是 (从增大或减小压强,
升高或降低温度,增大或减小NO2、N2O4的浓度,加
入或撤走催化剂方面回答)。
25.(10分)下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
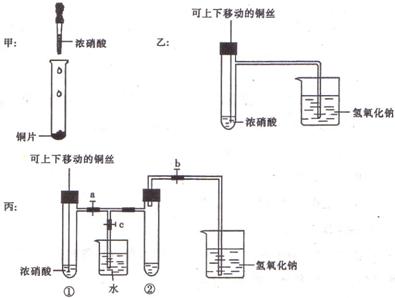
(1)甲、乙、丙三个装置中共同发生的化学方程式是 。
(2)和甲装置相比,乙装置的优点是① ,② 。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。实验时先关闭活塞 填代号,下同),再打开活塞 ,才能使NO2气体充满②试管;当气体充满②试管后,将铜丝提起与溶液脱离。欲使烧杯中的水进人②试管,应如何操作?
.
26.(6分)有A、B、C、D、E、F六种化合物,其中A、B、C、D都是铝元素的化合物,F是一种气体,F在标准状况下的密度是空气密度的1.103倍.化合物间可以发生如下反应:
A + NaOH →D + H2O
B →A + H2O
C + NaOH(适量)→ B +NaCl
E + H2O →NaOH + F
试确定物质的化学式:A ,B ,C ,
D .
1molC和2molE在水溶液中发生反应的化学方程式为:
。
27.(12分)右图是元素周期表的一部分。已知②④⑥⑦元素都存在同素
异形体。试回答下列问题:
(1)、形成化合物种类最多的元素是 。
| ① | ||||
| ② | ③ | ④ | ⑤ | |
| ⑥ | ⑦ | ⑧ | ||
| ⑨ | ||||
| ⑩ | ||||
(2)、气态氢化物能与其最高氧化物对应水化物反应生成盐
的元素是 ;
(3)、②至⑤号元素的原子半径由大到小的顺序为
;
⑷、③的单质的电子式为 ;
⑸、②与⑧形成的一种五核化合物,其分子属于 分子(填极
性与非极性);
⑹、⑦的气态氢化物或⑦的某种氧化物的水溶液,都能与⑨元素的单质反应。试写出其中不属于置换反应的化学方程式:
。
28.(8分)下图中每个方框中的字母代表一种反应物或生成物,其中反应①的产物未全部给出。
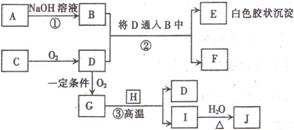
已知:A、C、H为常见非金属单质,D为有刺激性气味的有毒气体,B、F为钠盐的水溶液,且都呈碱性,E、J均为最高价含氧酸,且1molJ最多可和3molNaOH反应.请回答:
(1)写出下列物质的化学式(分子式)E________________,J_____________________。
(2)写出反应①的离子方程式:________________________________ 。
(3)写出反应③的化学方程式:________________________________ 。
29.(2分)由-OH,-CH3,-COOH,-C6H5和-CHO五种基团中的两种不同基团两两组合形成的化合物中,其水溶液能使紫色石蕊试液变红的有 种.
30.(2分)在常温下,PH值等于3的盐酸、FeCl3溶液和PH值11的Ba(OH)2溶液中,由水电出来的H+ 浓度分别为a、b、c,则a、b、c之间的大小关系为 (用<、>、=来表示)。
三、(本题包括1小题,共12分)
31.在一个容积固定的密闭容器中,维持一定温度,在一定条件下发生反应:
A(g)+2B(g)= 3C(g)的可逆反应.已知,起始时加入1molA和3molB,达平衡时生成amolC,此时C 的体积分数为w%,在相同实验条件下进行相同反应,请回答下列 问题.
⑴、若在起始时在同一容器中加入2molA和6mol B,达平衡时,生成的C为 mol;此时C在平衡混合物中的体积分数 w%(填<、=、>);
⑵、若起始时在同一容器中加入的是1.2mol的C ,而要求达平衡时C的物质的量为0.5a mol,且平衡时C 的体积分数仍为w%,则还应向容器中加入 mol的A和 mol的B.
⑶、若起始时在同一容器中加入2molA和8molB, 且平衡时C 的体积分数仍为w%,则还应向容器中加入 mol的C,且平衡时C的物质的量为 mol.
高三第7次月考化学试卷答案
1.B 2.D 3.C 4.A 5.A 6.D 7.A 8.B 9.C 10.C 11.B 12.C 13.A 14.A
15.D 16. C 17. B 18.A 19.B 20.A 21.D 22.C 23.B
24.升高高温度
25.(1)Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O(3分)
(2)①可以控制反应(1分);②可吸收NO2气体,防止污染环境(1分)
(3)c(1分);a、b(2分);先关闭b,再关闭a,然后打开c,用手捂住试管②(合理答案均给分) (4分)
26.⑴.A Al2O3 B Al(OH)3 C AlCl3 D NaAlO2 ;
⑵.ALCl3 + 2Na2O2 = NaAlO2 + 3NaCl + O2↑
27.(1)②
(2)③
⑶⑤<④<③<②
⑷略
⑸非极性
(6)SO2+Br2+2H2O=H2SO4+2HBr(2分)
28.(1)H2SiO3(2分);H3PO4(2分)
(2)Si+2OH-+H2O=SiO![]() +2H2↑(2分)
+2H2↑(2分)
(3)5SO3+2P![]() 5SO2+P2O5(2分)
5SO2+P2O5(2分)
29.5
30.b>a=c
31.⑴、2a ,=
⑵、0.1,0.7
⑶、6,4a