高三化学二轮复习电化学专题训练
微型专题训练——电 化 学
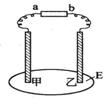
 1.2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是
1.2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是
A.左边为该电池的负极 B.该电池可在高温环境下使用
C.该电池负极反应为:H2—2e-=2H+
D.该电池正极反应为O2+4e-=2O2-
2.将质量相等的铜片和铂片插入硫酸铜溶液中,铜片与电源正极相连铂片与电源负极相连,以电流强度1A通电10min,然后反接电源,以电流强度2A继续通电10min。下列表示铜电极、铂电极、电解池中产生气体的质量和电解时间的关系图正确的是
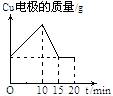
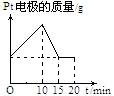
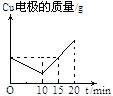
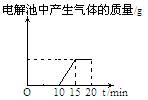
A. B. C. D.
3、镍-镉可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,放电时的电极反应式是 Cd+2OH-—2e-===Cd(OH)2,
2NiO(OH)+2H2O+2e-===2Ni(OH)2+2OH-
 下列说法不正确的是
下列说法不正确的是
A.电池的总反应式是Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
B.电池充电时,镉元素被还原
C.电池放电时,电池负极周围溶液的pH不断增大
D.电池充电时,电池的负极和电源的正极连接
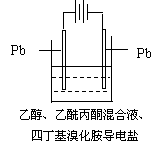 4.有机电解制备的金属醇盐,可直接作为制备纳米材料的前体。以下是一种电化学合成金属醇盐的主要装置。在电解过程中,已知乙醇和乙酰丙酮(CH3COCH2COCH3)在阴极发生的电极反应为:
4.有机电解制备的金属醇盐,可直接作为制备纳米材料的前体。以下是一种电化学合成金属醇盐的主要装置。在电解过程中,已知乙醇和乙酰丙酮(CH3COCH2COCH3)在阴极发生的电极反应为:
2CH3CH2OH+2e-=2CH3CH2O-+H2↑
![]()
下列说法正确的是
A.阳极Pb失去电子,发生还原反应
B.当阳极失去2 mol e— 时,阴极产生2 mol氢气
C.电解过程中,阳离子向阴极移动
D.已知Pb-4e—=Pb4+,当消耗Pb的质量为103.5 g时,则转移电子2 mol
5. 如图所示,E是用CuCl2溶液和品红试液的混合液湿润的滤纸,用石墨作电极,通电后发
|
A、b是阳极,a是阴极
B、a是正极,b是负极
C、乙是正极,甲是负极
D、乙是阳极,甲是阴极
![]() 6.我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池,常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),电池反应通常表示为
6.我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池,常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),电池反应通常表示为
LaNi5H6+6NiO(OH) LaNi5+6Ni(OH)2
下列说法正确的是
A.放电时储氢合金作正极 B.放电时负极反应:LaNi5H6+6OH--6e- = LaNi5+6H2O
 C.充电时阳极周围c(OH-)增大 D.充电时储氢合金作负极
C.充电时阳极周围c(OH-)增大 D.充电时储氢合金作负极
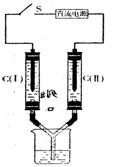
7.如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S后,C (Ⅱ)附近溶液变红,两玻璃管中有气体生成。下列说法正确的是
A.C(Ⅰ)的电极名称是阴极
B. C(Ⅱ)的电极反应式是2Cl--2e-=Cl2↑
C. 电子从电源的负极沿导线流向C(Ⅱ)
D.电解过程中,C(Ⅰ)、C(Ⅱ)两极产生的气体质量相等
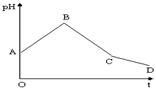 8、将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如右,则上列说法正确的是:
8、将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如右,则上列说法正确的是:
A.阳极产物一定是Cl2,阴极产物一定是Cu
B.BC段表示在阴极上是H+放电产生了H2
C.整个过程中阳极先产生Cl2,后产生O2
D.CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+
9、高铁电池是一种新型可充电电池,与普通高能电池相比,
该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
![]() 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3
+ 4KOH
3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3
+ 4KOH
下列叙述不正确的是:A.放电时负极反应为:Zn — 2e— + 2OH— == Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 — 3e— + 5OH— == FeO42— + 4H2O
C.放电时每转移3moL电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
10.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和PH。则电解过程中转移的电子数为( )
A、0.1mol B、0.2mol C、0.3mol D、0.4mol
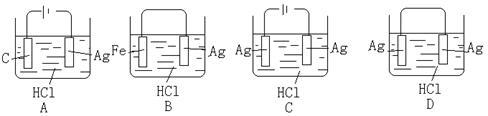
11、某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的是:
12、已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。关于标有“+”的接线柱,下列说法中正确的是 A.充电时作阳极,放电时作正极 B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
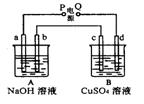
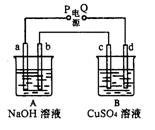 13、按右图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液。通电一 段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5 g (不考虑水的蒸发)。 则下列叙述中正确的是
13、按右图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液。通电一 段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5 g (不考虑水的蒸发)。 则下列叙述中正确的是
A.电源P极为负极
B.标准状况下,b极产生气体的体积为5.6 L
C.c极上析出固体的质量为16 g
D.a极上所发生的电极反应式为40H--4e-= 2H2O+O2↑
14、工业上电解质量分数为23.4%的精制食盐水a kg,电解后残液的密度为ρ kg/L。将产生的H2、Cl2在一定条件下反应制成质量分数为36.5%的盐酸b kg,已知H2、C12的利用率均为c%。则下列说法不正确的是:
A.电解食盐水反应的离子方程式为2Cl―+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.电解后残液中氯化钠的质量分数为w(NaCl)=![]() ×100%
×100%
C.电解后残液中NaOH的物质的量浓度为c(NaOH)=![]() mol/L
mol/L
D.电解时阳极上所发生的电极反应式为40H--4e-= 2H2O+O2↑
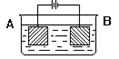 15.用下图装置进行电解实验:A极是铜锌(均匀)合金,B极为纯铜,电解质溶液中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,
15.用下图装置进行电解实验:A极是铜锌(均匀)合金,B极为纯铜,电解质溶液中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,
此时B极质量增加7.68克,溶液质量增加0.03克。
则下列说法不正确的是:
A、电解实验时阳极反应为 Zn-2e-=== Zn2+ Cu-2e-==Cu2+
B、电解实验时阴极反应为 Cu2++e-==Cu C、电极B上增加的7.68克物质均为铜
D、电极合金中Cu、Zn原子个数比为3∶1
16.将1L一定浓度的CuSO4溶液,用a,b两个石墨作电极电解,当a极上产生22.4L(标准状况)气体时,b极上有金属析出,然后将a,b极电源反接,继续通直流电,当b极上又产生22.4L(标准状况)气体时,溶液质量共减少227g。则下列说法正确的是:
A 、a极上产生22.4L(标准状况)气体时,b极增加的质量为128g
B、原CuSO4溶液的物质的量浓度为2.5mol/L C、电源反接后b极上产生的气体是氢气
D、电源反接后继续通直流电使溶液质量减少量达到227g的过程中不可能有H2 析出
 17.按右图装置实验,A、B两烧杯分别盛放200g10%NaOH和足
17.按右图装置实验,A、B两烧杯分别盛放200g10%NaOH和足
量CuSO4溶液。通电— 段时间后,c极上有Cu析出;又测得A杯中
溶液的质量减少4.5 g (不
考虑水的蒸发)。 则下列叙述中正确的是
A.电源P极为负极 B.标准状况下,b极产生气体的体积为5.6 L
C.c极上析出固体的质量为16 g
D.a极上所发生的电极反应式为4OH--4e-= 2H2O+O2↑
18.汽车的启动电源常用铅蓄电池,放电时的电池反应如下:
PbO2+Pb+2H2SO4=2PbSO4↓+2H2O,根据此反应判断下列叙述中正确的是
A.Pb O2是电池的负极 B.负极的电极反应式为:Pb+SO42--2e-=PbSO4 ↓
C.电池放电时,PbO2得电子,被氧化 D.电池放电时,溶液酸性增强
19.近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可
用电解法制取,以石墨和铁为电极,以KI溶液为电解液在一定条件下电解,反应式为
KI+H2O→KIO3+H2↑。下列有关说法中,正确的是
A.电解时,石墨做阳极,铁作阴极 B.电解时,在阳极上产生氢气
C.电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D.电解中,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体
20.当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是
A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
B.电池的正极反应式为:O2十2H2O十4e—==4OH—
C.电解后c(Na2CO3)不变,且溶液中有晶体析出
 D.电池中c(KOH)不变;电解池中溶液pH变大
D.电池中c(KOH)不变;电解池中溶液pH变大
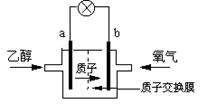
![]() 21. 2004年美国圣路易斯大学科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 2CO2
+3H2O,电池示意如右图。下列说法不正确的是 A.a极为电池的正极
21. 2004年美国圣路易斯大学科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 2CO2
+3H2O,电池示意如右图。下列说法不正确的是 A.a极为电池的正极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ +O2 +4e- = 2H2O
D.设每个电子所带电量为q库仑,则1mol乙醇被氧化产生6NAq库仑的电量
22.(05年江苏宿迁市二模,17)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:![]() 则下列说法正确的是 A.放电时CH3OH参与反应的电极为正极
则下列说法正确的是 A.放电时CH3OH参与反应的电极为正极
B.放电时负极的电极反应为:![]()
C.标准状况下,通人5.6LO2并完全反应后,有O.5mol电子转移
D.放电一段时间后,通人O2的电极附近溶液的pH降低
23.(05年扬州市三模,12)生物体中细胞膜内的葡萄糖与细胞膜外的富氧体液及细胞膜构成原电池,下列有关电极反应及产物的判断正确的是
A.负极反应可能是O2+2H2O+4e→4OH--
B.负极反应的产物主要是C6H12O6被氧化成CO32-- HCO3--和H2O
C.正极反应可能是C6H12O6+24OH---24e→6 CO2↑+18H2O
D.正极反应的产物主要是葡萄糖生成的CO2 HCO3--和H2O
24.(05年淮安市四模,11)某混合溶液中只含有两种溶质NaCl和H2SO4,且n(NaCl):n(H2SO4)=3:2。若以石墨电极电解该溶液,下列推断中不正确的是
A.阴极产物为H2 B.阳极先析出Cl2,后析出O2
C.电解液的pH不断增大,最终大于7 D.整个电解的过程实质是电解水
25.(05年无锡市期末,16)氢氧燃料电池以铂作电极,KOH溶液作电解质溶液。对该电
池的说法正确的是
A.负极反应为O2+2H2O+4e-===4OH- B.电池工作时,正极区pH升高
C.电池工作时溶液中的阴离子移向正极 D.电池的总反应为:2H2+O2===2H2O
26.纽扣电池的电极反应式为:Zn+2OH—2e-=ZnO+H2O;
Ag2O+H2O+2e-=2Ag-+2OH-。下列说法中,错误的是
A.Zn是负极,Ag2O是正极 B.电池放电时,电解质溶液的pH基本保持不变
C.Ag2O发生了还原反应 D.电池放电时,溶液中OH-向正极移动,H+向负极移动
27.实验室用惰性电极电解稀硫酸。下列有关描述中,正确的是
A.电解时,与电源负极相连的电极上产生H2
B.电解时,阳极反应是:4OH—4e-=O2↑+2H2O
C.在两极上放电的阴、阳离子的物质的量之比是2:1
D.电解过程中,溶液的pH不变
28.理论上不能设计原电池的化学反应是
A.CH4(g)+2O2(g)→CO2(g)+2H2O(l);ΔH<0
B.HNO3(l)+NaOH(l)=NaNO3(l)+H2O(l);ΔH<0
C.2H2(g)+O2(g)=2H2O(l);ΔH<0 D.2FeCl3(l)+Fe(s)=3FeCl2(l);ΔH<0
29.甲、乙两个电解池各含有一种电解质溶液,均以Pt作电极且相互串联,甲池中盛有AgNO3溶液,乙池中盛有另一种盐溶液,通电一段时间后,测得甲池电极上析出金属2.16g,乙池电极上析出金属0.64g,则乙池电解质溶液中的溶质可能是
A.MgSO4 B.Al(NO3)3 C.CuSO4 D.Na2SO4
30.某溶液中含有两种溶质NaCl和 H2SO4,它们的物质的量之比为3:1。用石墨作电极电解该溶液时,根据电极产物,可明显地分为三个阶段,则下列有关三个阶段的实验现象及溶液的PH变化的分析中,不正确的是
A、电解的三个阶段分别相当于:电解HCl、NaCl、Na2SO4
B、电解时两极始终有气体产生,且阳极均为刺激性气味气体
C、阳极先生成氯气,后来生成氧气
D、阴极生成物只是H2
31.用惰性电极电解NaCl和CuSO4混合溶液250ml,经过一段时间后两极均得到11.2L气体(标准状况下),则下列有关描述中,正确的是
A 阳极发生的电极反应只有:40H--4e-= 2H2O+O2↑
B 两极得到的气体均为混合物气体
C 若Cu2+的起始浓度为1mol/L则C(Cl—)起始为2mol/L
D Cu2+的起始浓度最大应小于2mol/L
32.(05年吉林省实验中学第一次检测)在20℃时食盐水的溶解度为36g,取一定量该温度下的饱和溶液用惰性电极进行电解,当阳极析出11.2L气体时(标准状况),食盐水完全电解,所得溶液密度为1.20g/mol。试计算:
(1)电解时,所取饱和食盐水的质量为 g。
(2)电解后溶液中NaOH的物质的量浓度为 mol/L。
(3)要使溶液恢复原状态,需加入 g, 物质。
33.将铝件与另一种材料作电极,以某种溶液作电解液进行电解,通电后在铝件与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部分存在着小孔,电流从小孔通过并产生热量使Al(OH)3分解,从而在铝件表面形成一层较厚的氧化膜。某校课外兴趣小组根据上述原理,以铝件和铁棒为电极,一定浓度的NaHCO3溶液为电解液进行实验。
(1)铝件表面形成Al(OH)3的电极反应式是: __________________________________。
(2)电解过程中,必须使电解液pH保持相对稳定(不能太大,也不能太小)的原因是_______________________________________。
(3)用NaHCO3溶液作电解液,会减缓阴极区溶液pH的增大,能说明这一原理的离子方程式为_____________________________________。
34.用石墨电极电解标准状况下500ml0.4mol/L的CuSO4溶液,电解2min放出气体560ml(标准状况下),然后反接,再电解4min。(假定电流强度和溶液体积不变)求:电解这6min后,放出气体的体积(标准状况下)。
参考答案:1C2BC3CD4CD5D6B7C8C9C10D11C12A13AC14D15B16AB
17AC18B19AD20BC22B23B24CD25BD26D27AB28B29C30B31CD
32.(1)221 (2)6.5 (3)3.65HCl
33.(1)Al-3e-+3HCO3-===Al(OH)3↓+3CO2↑
(或Al-3e-===Al3+ Al3++3HCO3-===Al(OH)3↓+3CO2↑)
(2)Al(OH)3、Al2O3具有两性,电解液的酸性或碱性过强,都会使所形成的Al2O3薄膜溶解
(3)HCO3-+OH-===CO32-+6H2O