高三化学一中联考试题
1.我国于2006年启动定名为“嫦娥工程”的探月工程.登月的重要意义在于探索月球为人类造福.已知月球上深度3米以内的氦—3有70多万吨,如果用于核反应发电,可供地球上的人类使用7千年.氦—3与氦—4的关系是( )
A.同分异构体 B.同素异形体 C.同位素 D.同一物质
2.设NA为阿伏加德罗常数,下列说法中不正确的是( )
A.质子总数为5NA的重水(D2O)是0.5mol
B.在标准状况下,11.2L甲烷和乙烯的混合物所含氢原子的数目为2NA
C.1molFeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA
D.据报导,科学家已成功地制得类似SiO2结构的CO2原子晶体,则4.4g该CO2原子晶体所含的共价键的数目为0.4NA
3.2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为:①2MoS2 + 7O2 ![]() 2MoO3 + 4SO2;
2MoO3 + 4SO2;
②MoO3 + 2NH3·H2O
= (NH4)2MoO4 + H2O;
③(NH4)2MoO4 + 2HCl = H2MoO4↓+
2NH4Cl;④H2MoO4 ![]() MoO3 + H2O;⑤用还原剂将MoO3还原成金属钼。
MoO3 + H2O;⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是( )
A.MoS2煅烧产生的尾气可直接排空
B.MoO3不溶于氢氧化钠溶液
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,消耗还原剂的物质的量之比为3:3:2
3.在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中加入足量的Na2O2固体,充分作用后,再加入过量的稀盐酸,完全反应,则离子数目没有变化的是( )
A.Fe3+、Al3+ B.Al3+ C.Fe2+、NH4+ D.Fe3+
4.①.由C(石墨)→C(金刚石);△H=+119KJ/mol可知,金刚石不如石墨稳定
②.保持温度不变,用铜棒作电极电解饱和Na2SO4溶液,一段时间后溶液的pH增大
③.不用其它试剂就能鉴别Na2CO3、Al2(SO4)3、NaCl和NaHSO4四种溶液
④.为保证加酶洗衣粉的洗涤效果,应使用沸水先冲泡洗衣粉
⑤.“酸可以去锈”、“洗涤剂可以除油”都是发生了化学变化
上述说法中错误的是( )
A.①②③ B.②③④ C.②④⑤ D.①④⑤
![]() 6.一定温度下,在容积可变的容器中,反应达到平衡时,SO2(g)、O2(g)和SO3(g)的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,按下列要求改变条件,达到新平衡时各物质的百分含量与原平衡相同的是( )
6.一定温度下,在容积可变的容器中,反应达到平衡时,SO2(g)、O2(g)和SO3(g)的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,按下列要求改变条件,达到新平衡时各物质的百分含量与原平衡相同的是( )
A、通入1molN2(g) B、通入1molO2(g)
C、通入1molSO3(g) D、三种平衡混合物各移走1mol
7.t℃时,水的离子积为Kw,该温度下将amol·L-1一元酸HA与bmol·L-1一元碱BOH等体积混合,要使混合液显中性,必要的条件是( )
A、混合液的PH=7 B、混合液中,Kw={c(H+)}2
C、a=b D、混合液中,c(B+)+c(H+)=c(A-)+c(OH-)
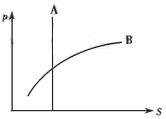 8.已知摩尔质量相等的化合物A和B,在25℃时,其溶解度(S)与压强(P)的关系如图所示,则在该温度下,同体积的A和B溶于等体积水(均形成溶液)后,c(A)与c(B)关系正确的是( )
8.已知摩尔质量相等的化合物A和B,在25℃时,其溶解度(S)与压强(P)的关系如图所示,则在该温度下,同体积的A和B溶于等体积水(均形成溶液)后,c(A)与c(B)关系正确的是( )
A、c(A)>c(B) B、c(A)<c(B)
C、c(A)=c(B) D、无法确定
9、(17分)下表是元素周期表的一部分,表中所列字母分别代表化学元素。就表中所列字母所代表的元素,回答下列问题。
| a | |||||||||||||||||
| b | c | ||||||||||||||||
| d | e | f | g | h | |||||||||||||
| i |
请填空:
(1)元素电负性的X数值表示不同的原子在分子内吸引电子能力的大小,若X值越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方。当两种元素的电负性差值越大,键的极性越大。小于1.7时,这两种元素通常形成共价化合物。下表是部分主族元素的电负性:
| H:2.1 | ||||||
| Li:1.0 | Be:1.5 | B:2.0 | C:2.5 | N:3.0 | O:3.5 | F:4.0 |
| Na:0.9 | Mg:y | Al:1.5 | Si:1.8 | P:2.1 | S:2.5 | Cl:3.0 |
| K:0.8 | Ca:1.0 | Ga:1.6 | Ge:1.8 | As:2.0 | Se:2.4 | Br:2.8 |
①X值的大小也可以作为判断金属性和非金属性的强弱的尺度。金属的X值一般小于 。d元素的电负性(y)的大小范围为 。由上表可以得出同周期元素的电负性X值与原子半径大小的一般关系是: 。
②在元素周期表中X值最大的元素,与a元素形成的化合物不能保存在玻璃容器中,原因是(用化学方程式表示) 。
(2)元素c与h形成的化合物是一种广谱型的消毒剂,根据世界环保联盟的要求,此化合物将逐步取代Cl2成为自来水的消毒剂,此化合物的化学式为: ,它的晶体类型是: 。
(3)a元素和b元素组成的化合物的空间构型是 (不用画图),工业上合成此化合物的适宜条件是 。
(4)e与h形成的化合物水解的离子方程式为 。
(5)i元素在元素周期表中的位置是 。
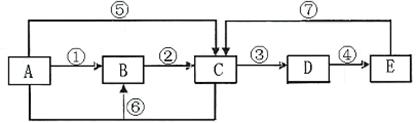
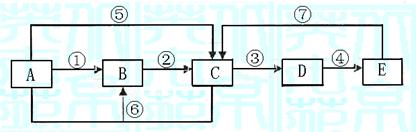
10.(13分)已知下列转化关系中的中学化学常见物质A、B、C、D、E中均含有同一种元素,A、C均为气体,E为液体,下图中箭头上的反应物和反应条件均已略去。
|
(1)当A与E发生化合反应时,能观察到空气中形成大量的白烟,则A→E共同含有甲
元素。可知:B的电子式为 。室温下,将铜片和铁片用导线相连插入足量E的浓溶液中组成原电池,铁片作 极,其电极方程式为: 。当小心加热A与E化合的生成物F时,可能得到一种无色无味的气体G﹝相对分子质量为44﹞和一种无色无味的液体H,写出F分解生成的G+H的化学方程式 。
(2)当A与E反应生成B和C时,则A→E共同含有乙元素。此时:B为淡黄色固体,C气体易液化,常温常压下D是气体,冰水冷却D时变成无色晶体,此无色晶体的化学式是 ,在A→E各物质中,一定条件下能与D发生氧化还原反应的物质有
(填字母)。D溶于纯净的E时,能按物质的量比1:1化合,生成物的化学式可表示为
(写成化合物、复合物或氧化物均可)。
11.(14分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂。某研究性学习小组设计了下面的实验装置来制备摩尔盐。
实验步骤:
(1)把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得摩尔盐。
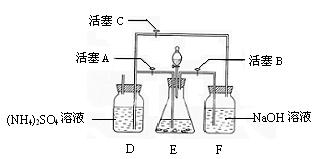
试回答下列问题:
(1)F中的NaOH溶液的主要作用是
(2)Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作时应先关闭活塞 ,并同时打开活塞 。请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用
(3)使摩尔盐结晶可采取两种方法:①蒸发溶液、再自然冷却结晶;②不蒸发溶液、直接自然冷却结晶。你认为较好的方法是 。(填序号)
(4)原料利用率高、副产品少、产生的有害废物少、保护环境等是“绿色化学”的主要内涵。请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
、 。
12、(16分)0.2mol有机物A在氧气中完全燃烧后,生成79.2gCO2和18g水,同时消耗O247.04L(标准状况),A在光照条件下生成的一溴代物B,可发生如下转化关系(无机产物略):
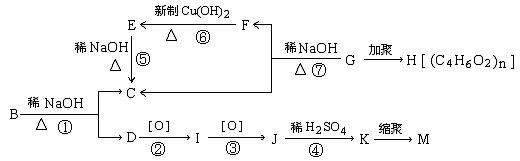
其中K与FeCl3溶液能发生显色反应,且环上的一元取代物只有两种结构。已知:
①当羟基与双键碳原子相连时,易发生如下转化:RCH=CHOH—→RCHCHO。
② —ONa连在烃基上不被氧化。
请回答下列问题:
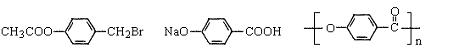
(1)写出结构简式:B:____________I:______________M:________________
(2)上述变化过程中,属于取代反应的是(填编号① ② ③……)______________
(3)写出下列反应的化学方程式(有机物用结构简式表示)。
①G—→F+C: ________________________________________________
②D—→I:_____________________________________________________
③K与过量的Na2CO3溶液反应:__________________________________________
(4)同时符合下列要求的A的同分异构体有__________种。
①含有苯环 ②能发生银镜反应和水解反应
③在稀NaOH溶液中,1mol该同分异构体能与1molNaOH反应
化学参考答案:
1.C 2.C 3、D 4.B 5.C 6.C 7、B 8.A
9、(17分)(1)①1.8 1.0<y<1.或0.9<y<1.5 X值越大,半径越小
(前面每空各1分,后面每空各2分)
②SiO2+4HF=SiF4↑+2H2O (2)ClO2 分子晶体
(3)三角锥形 20Mpa~50Mpa、500℃、铁触媒作催化剂
(4)Al3++3H2O ![]() Al(OH)3+3H+
Al(OH)3+3H+
(5)第四周期第Ⅷ族
10.(13分)
(1)![]() ;正(此空1分,其余每空各2分) NO3-+2H++e-=NO2↑+H2O ;
;正(此空1分,其余每空各2分) NO3-+2H++e-=NO2↑+H2O ;
![]()
(2)SO3;AB;H2S2O7或H2SO4·SO3或2SO3·H2O
11.(14分,每空各2分)
(1)除去混在氢气中的酸性气体
(2)A B、C 将E中的产生的硫酸亚铁溶液压入D中
(3)② (4)用氢氧化钠溶液除去混在氢气中的酸性气体;氢氧化钠溶液重复使用;用氢气驱赶氧气,防止亚铁盐被氧化等其它合理答案
12.(16分,每空各2分)
(1)
(2)①⑦
(3)①CH3COOCH=CH2+NaOH→CH3COONa+CH3CHO
②![]()
③![]()
(4) 4