高三化学三月月考试题
6.在实验中不慎手被玻璃划破,可用FeCl3溶液应急止血,其主要原因是
A.FeCl3溶液具有杀菌消毒作用 B.FeCl3溶液能使血液凝聚
C.FeCl3溶液能产生Fe(OH)3沉淀堵住伤口 D.FeCl3能使血液发生化学作用
7.18g18O22-微粒中含有
A.1mol离子 B.9mol中子 C.9mol电子 D.10mol质子
8.用铁作阴极,石墨作阳极电解含Mg2+、Ca2+、SO42-杂质的饱和食盐水,通电一段时间后,发现某电极附近食盐水变浑浊,对造成浑浊的原因叙述正确的是
A.由于H+放电,故生成Mg(OH)2 B.由于Cl-放电,故生成Mg(OH)2
C.由于铁溶解生成Fe(OH)2 D.由于H+放电,故生成Ca(OH)2
9.中学化学课本中有大量的数据材料,下面是某学生对数据的利用,其中不正确的是
A.利用溶解度数据可判断煮沸Mg(HCO3)2溶液时,得到的产物是Mg(OH)2而不是MgCO3。
B.利用密度数据可判断液态物质挥发性的大小。
C.原子(或离子)半径数据可作为判断某些原子(或离子)的氧化性或还原性的依据。
D.利用沸点数据可判断液态物质挥发性的大小。
10.下列离子方程式正确的是
A.次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
B.常温时偏铝酸钠溶液pH>7 AlO2-+2H2O=Al(OH)3↓+OH-
C.等物质的量浓度的FeI2溶液与溴水等体积混合2Fe2++2I-+2Br2=2Fe3++I2+4Br-
D.向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至中性2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
11.已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
A.该温度高于25℃
B.由水电离出来的[H+]=1×10-10mol/L
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使反应后的溶液恰好呈中性
12.某无色溶液中可能含有I-、Fe3+、Na+、SO32-四种离子中的一种或几种,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于该溶液组成的判断正确的是
①肯定不含Fe3+ ②肯定含I- ③可能含有I- ④肯定含SO32- ⑤肯定含Na+ ⑥可能含Na+
A.①③④ B.③④⑥ C.①②④ D.①③④⑤
13.在一定容积的密闭容器中,加入2LX(g)和3LY(g),发生如下反应:nX(g)+3Y(g) ![]() 2R(g);ΔH=-QKJ/mol,平衡后,测得X和Y的转化率分别为a%和b%,已知a<b,则n值为
2R(g);ΔH=-QKJ/mol,平衡后,测得X和Y的转化率分别为a%和b%,已知a<b,则n值为
A.1 B.2 C.3 D.4
![]() 26.(10分)m,n,x,y四种主族元素在周期表里的相对位置如图所示,
26.(10分)m,n,x,y四种主族元素在周期表里的相对位置如图所示,
已知它们的原子序数总和为46,则:
(1)元素n的气态氢化物的电子式为 。
(2)m与y所形成的化合物为 ,属于 分子。
(3)x的原子结构示意图为 。
(4)由n,y的氢化物相互作用所生成的物质的电子式为 。
27.(20分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:
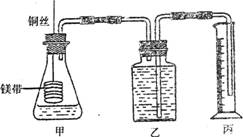 |
①配制浓度均为0.5mol/L H2SO4和H2C2O4溶液;
②用 量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带ag,并系于铜丝末端,a的数值至少为 ;
④检查装置的气密性,在广口瓶中装满水,按图连接好装置;
⑤将铜丝向下移动,使足量镁带浸人酸中(铜丝不与酸接触),至反应完全,记录
;
⑥反应结束后,读取量筒内水的体积为VmL。
请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84g·cm-3,98%的浓H2SO4配制浓度为0.5mol/L的H2SO4溶液,所需要的仪器为 。
(2)用文字表述④检查装置气密性的操作与观察方法:
。
(3)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积。这三步操作的正确顺序是 。(填序号)
(4)读取量筒内水的体积时,若丙中液面高于乙中液面,如何使乙、丙中液面相平?
。
(5)本实验中应选用 (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(6)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:
Vm= 。
(7)简述速率不等的原因 ,铜丝不与酸接触的 原因是 。
28.(16分)煤的气化和液化是使煤变成清洁能源的有效途径。煤气化的主要反应是:水蒸气跟灼热的焦炭反应,生成A和P的混合气体,它是合成多种有机物的原料气。如图是合成某些物质的路线。
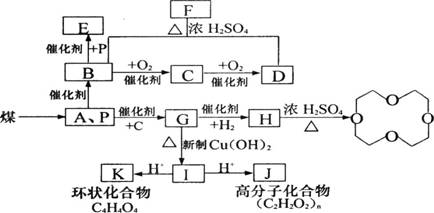 |
其中,E、F、G互为同分异构体,且G能与新制Cu(OH)2反应;D、E是相邻的同系物。请回答下列问题:
(1)写出下列物质的化学式A P
(2)写出下列物质的结构简式B G K
![]()
![]() (3)已知环氧乙烷(
的结构可简写为 ,则
的分子式是
。
(3)已知环氧乙烷(
的结构可简写为 ,则
的分子式是
。
(4)写出下列反应的化学方程式并说明反应类型
G+Cu(OH)2→I
反应类型 。
I J
反应类型
29.(14分)(1)在室温下,分别取n mol Na、Mg、Al投入到4mol·L-1的V(L)盐酸中,充分反应,要使反应放出的H2符合题中要求,请将V的取值范围填在横线上(用n来表示)
①Na反应放出的H2最多 ;
②Mg、Al放出的H2几乎一样多 ;
③Na、Mg、Al放出的H2几乎一样多 ;
④Al放出的H2最多 。
(2)在室温下,分别取m g Na、Mg、Al投入到4mol·L-1的V(L)盐酸中,充分反应,要使反应放出的H2符合题中要求,将V的取值范围填在横线上(用m来表示)
①Al放出的H2最多
②Na放出的H2最多
③Mg、A1放出的H2几乎一样多 。
6.B 7.C 8.A 9.B 10.D 11.D 12.D 13.A
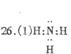 | |||
(2)CCl4,非极性
27.(1)②酸式滴定管 ③0.12 ⑤反应起止时间
(1)量筒,烧杯,玻璃棒,容量瓶,胶头滴管
(2)两手掌紧贴锥形瓶外壁一会,如观察到广口瓶中长导管内有一段水柱升出液面,表明装置不漏气
(3)②①③ (4)将量筒缓缓向下移动,使乙、丙中液面相平
(5)B (6)0.2VL/mol
(7)酸的浓度相同时c(H+)不同 防止形成原电池,干扰实验现象的观察
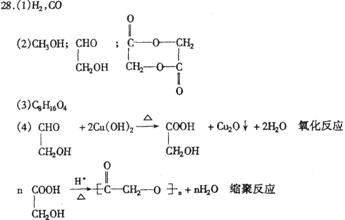
29.(1)C2H2O2 (2)18 (3)C6H10O8
![]()
![]()
![]()
![]() 29.(14分)(1)①
②
③
④
29.(14分)(1)①
②
③
④
(1)① ② ③