高三化学三月质检试题
试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分为108分,考试时间为90分钟。考生将答案填入答题卡中方有效。
相对原子质量:H-1 O-16 Cl-35.5 Cu-64 N-14 Fe-56 S-32 Ba-137 P-31 Zn-65
第Ⅰ卷 选择题(共18个小题,每小题3分,共54分)
一、选择题(每小题只有一个选项符合题意)
1.关于工业接触法制硫酸的说法正确的是
A.由于SO2被氧化成SO3的反应为气体体积缩小的反应,所以硫酸工厂通常采用高压
B.SO2氧化反应在400℃~500℃下进行,是因为高温有利于提高SO2的转化率
C.接触室里热交换器的主要功能是把反应放出的热量传递给需要预热的反应混合气体
D.由于硫酸厂对环境的污染,故应远离消费中心
2.下列叙述中错误的是
A.SiO2是光导纤维的主要成份
B.氧化铝陶瓷、氮化硅陶瓷都是主要的高温结构陶瓷
C.制造蓝色玻璃加入的物质是Co2O3 ,它可以滤去焰色反应中由钠元素产生的黄光
D.石灰石、高岭石、石英和水晶的主要成份都是SiO2
3.俄罗斯科学家发现了质量数为289的114号元素,用Uuq表示该元素。原子R比289Uuq原子核中质子数少103,则关于R的下列判断正确的是
A.它的质子数为103 B.它位于周期表第七周期
C.它位于周期表第ⅠA族 D.它有很强的氧化性
4.相同温度下,下列实验过程中,溶液的浓度和质量始终不变的是
A.向浓氨水中持续通入干燥洁净的空气(已除去CO2)
B.向KNO3饱和溶液中加入n g KNO3晶体
C.向98.3%浓H2SO4中加入n g SO3
D.向CuSO4饱和溶液中加入n g无水CuSO4
5.在温度一定时,用水稀释0.1mol · L – 1氨水时,溶液中随着水量的增加而减小的是
A.c (OH – ) / c (NH3 · H2O) B.c (NH3 · H2O) / c (OH – )
C.c (H + )和c (OH – )的乘积 D.OH – 的物质的量
6.将CO2持续通入下列八种饱和溶液:①Na2CO3 ②Na2SiO3 ③NaAlO2 ④C6H5ONa ⑤Ca(ClO)2 ⑥CaCl2 ⑦NH3和NaCl ⑧Ca(OH)2,最终能得到沉淀或析出晶体的是
A.②⑤⑧ B.⑤⑧⑥ C.①②③④⑦ D.②③④⑧
7.最近,美国Lawrece Lirermore国家实验室(LINL)的V·Lota·C·S·Yoo和H·cyrnn成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体说法正确的是
A.在一定条件下,CO2原子晶体转化为分子晶体是物理变化
B.CO2的原子晶体和CO2分子晶体具有相同的物理性质和化学性质
C.在CO2的原子晶体中,每个C原子结合4个O原子,每个O原子结合两个C原子
D.CO2的原子晶体和分子晶体互为同分异构体
8.下列事实能证明碳的非金属性比硅强的是
①Na2SiO3+CO2+2H2O === H4SiO4↓+Na2CO3 ②SiO2+2C 高温Si+2CO↑
③Na2CO3+SiO2高温Na2SiO3+CO2↑ ④CH4比SiH4稳定
A.①②③④ B.②③ C.③④ D.①④
![]() 9.根据下列实验事实,得出的结论正确的是
9.根据下列实验事实,得出的结论正确的是
![]() A.某试液
产生黄色沉淀,证明原试液中有I
–
A.某试液
产生黄色沉淀,证明原试液中有I
–
![]()
![]() B.某试液
溶液显红色,证明原试液一定是碱
B.某试液
溶液显红色,证明原试液一定是碱
C.某试液(浓溶液) 无明显现象 有红棕色气体放出,说明原试液中含有NO3 -
![]()
![]() D.某试液
无明显现象
未变蓝,则原溶液中一定不存在NH4+
D.某试液
无明显现象
未变蓝,则原溶液中一定不存在NH4+
10.将a mL NO、b mL NO2、 x mL O2的气体混合于同一试管里,将试管倒插入水中,充分反应后试管内气体全部消失,则x对a、b的函数关系式x=f(a,b)是
A.(a+b)/2 B.(2a+b)/3 C.(3a+b)/4 D.(4a+b)/5
11.将32.1gNH4Cl固体与过量Ca(OH)2固体共热,放出的气体全部被含39.2g溶质的磷酸溶液吸收,此时生成的盐是
A.NH4H2PO4 B.(NH4)2HPO4
C.(NH4)3PO4 D.NH4H2PO4和(NH4)2HPO4
12.据报道,某地一辆满载砒霜的大货车翻下山坡,滑下河道,部分砒霜散落到河水中。砒霜的主要成分是As2O3,剧毒,致死量为0.1g ,可用于制造杀虫剂和灭鼠剂等。As2O3是两性偏酸性氧化物,其无色晶体在193℃升华,微溶于水,生成H3AsO3(亚砷酸);其对应的盐也均有毒性,其中碱金属对应的盐溶于水,其它金属对应的盐几乎不溶于水。根据以上信息判断,下列说法正确的是
A.As2O3的晶体为原子晶体
B.As2O3是砷酸的酸酐
C.可向该河中撒入生石灰,以消除砷对河水的污染
D.可向该河水中撒入氢氧化钠,以消除砷对河水的污染
|
| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | 氢氧化钠溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性高锰酸钾溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀硫酸 | CaCO3固体 | 浓硫酸 |
14.1.92g Cu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为
A.504mL B.336mL C.224mL D.168mL
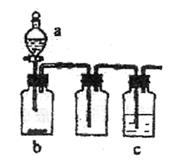
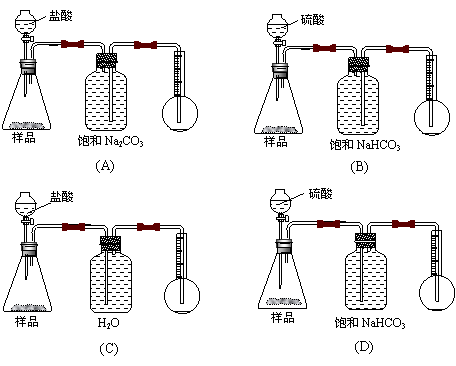 15.我国青海湖地区素有“夏天晒盐,冬天捞碱”之说。其中捞出的碱主要是碳酸钠和少量氯化钠的混合物。某同学以捞出的碱作为样品,并用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量,下列装置中正确的是
15.我国青海湖地区素有“夏天晒盐,冬天捞碱”之说。其中捞出的碱主要是碳酸钠和少量氯化钠的混合物。某同学以捞出的碱作为样品,并用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量,下列装置中正确的是
16.某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原硝酸的物质的量之比为1∶2时,还原产物是
A.NO2 B.N2O C.N2 D.NH4+
17.在一些电视剧中,为达到一定的特级效果,经常需要“烟幕”来配合。这里所需的“烟幕”有的是用NH4NO3和Zn粉按质量比8:6.5混合放于温热的石棉网上。使用时滴水数滴滴于上述混合物上即产生大量白烟,又知二者发生反应后只生成ZnO、N2、H2O生成。下列关于该反应的说法不正确是
A.NH4NO3中,既有离子键,又有共价键
B.在常温下,将NH4NO3固体溶于水,所得的溶液的pH小于7
C.在上述化学反应中,若有1molN2生成,则反应中转移的电子数为5mol
D.在上述化学反应中,Zn失电子的数目等于NO-3中的N得电子的数目
18.有混合气体X,它是由NO、H2、CO2组成,通入足量的Na2O2后,变成混合气体Y,将Y用电火花引燃使其充分反应,只得到质量分数为70%的HNO3溶液,无其它任何气体,则X中各气体体积之比为
A.2∶4∶7 B.4∶2∶7 C.7∶4∶2 D.3∶5∶8
第 Ⅱ卷 非选择题(54分)
(请将答案填到答卷的对应位置,答在试卷上无效)
二、实验题
19.(14分)(1)利用如图所示的装置和其它必要的仪器用品,完成下列实验。
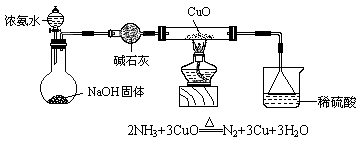 |
证明氨气具有还原性。已知:
① 碱石灰的作用是________________,稀硫酸的作用是_________________;
② 浓氨水与固体NaOH接触,为什么会逸出大量氨气? ______________________________________________________________ ;
③ 证明NH3具有还原性的实验现象是: 。
(2)水蒸气通过灼热的煤所产生的混合气体,其主要成分是CO、H2,还含有少量CO2和水蒸气。请用下图装置设计一个实验,以确认上述混合气中含有CO和H2。
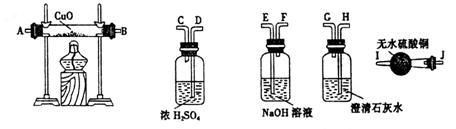 |
①连接上图装置的正确顺序是(填各接口代码字母):(已知洗气瓶中的溶液均足量)
混合气→( )( )接( )( )接( )( )接( )( )接( )( )。
②确认混合气中含有H2的实验现象是 ;
③确认混合气中含有CO的有关反应的化学方程为 ; 。
三、填空题
20.(10分)工业生产红矾钠(重铬酸钠Na2Cr2O7)及铬酸酐(CrO3)的工艺流程如下:①将铬铁矿(可视为FeO · Cr2O3,还含有Al2O3和SiO2)、纯碱混合通过空气焙烧(使铬转化为+6价的化合物);②焙烧产物加水,过滤并用硫酸调成弱酸性;③再过滤,滤液继续加硫酸酸化,浓缩、结晶成红矾钠;④红矾钠加浓硫酸熔化反应。反应完毕后趁热分液,冷却压片,即得片状铬酸酐。
(1)完成下列化学反应方程式:
|
|
②SiO2 + Na2CO3 ___ ____;③Al2O3 + Na2CO3
___ ____。
(2)用水浸取燃烧产物,并用硫酸调成弱酸性的目的是(写出有关反应的离子方程式)_______________________,______________ ___。
(3)过滤,除去杂质,滤液继续加硫酸酸化,浓缩结晶生成红矾钠的化学方程式是:
_________ ___。
21.(8分)铁与HNO3作用时,还原产物除了与HNO3浓度有关外,还与温度有关。已知在与冷稀HNO3反应时,主要还原产物为NO气体;在与热稀HNO3作用时,主要还原产物为N2O气体;当HNO3更稀时,其重要还原产物是NH4+。现有铁与稀HNO3作用,请分析下图,回答有关问题。
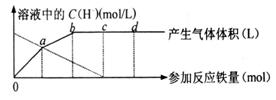 |
假设曲线的各段内只有一种还原产物。
(1)0点到a点的还原产物是 ;
(2)a点到b点的还原产物是 ,其原因是 ;
(3)试完成b点到c点的反应方程式:
![]() Fe+ HNO3===Fe(NO3)3+
+ H2O
Fe+ HNO3===Fe(NO3)3+
+ H2O
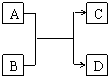 22.(14分)已知A、B、C、D分别代表中学化学常见物质(或粒子),
22.(14分)已知A、B、C、D分别代表中学化学常见物质(或粒子),
其中A、B均为两种元素组成的化合物(或粒子),相互转化关系如
右图(有关反应条件已略去)。请根据题目要求回答下列问题:
(1)若A、B两化合物相互反应得到气体单质C和化合物D,则
化学方程式为(只写一个): ;
(2)若A、B两化合物相互反应生成非金属固体单质C和化合物D,且A的相对分子质量大于B,则A、B的化学式分别为:A 、B ,该反应中氧化产物与还原产物的质量之比为 ;
(3)若A是含5个原子核构成的粒子,且A、B均为10电子粒子,含适量A、B粒子的溶液在加热条件下反应生成气体C和化合物D,则A粒子的电子式为 ,C分子的空间构型为 ,含A、B粒子的溶液转化为C、D的离子方程式为 。
四、计算题
23.(8分)有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0mol·L-1NaOH溶液反应,用去35mL碱液时恰好完全中和。试求:
(1)混合液中H2SO4、HNO3的物质的量浓度各是多少?
(2)另取10mL原混合液,加入3.2g铜粉共热时,在标准状况下收集到气体的体积约为多少毫升?
(3)若上述10mL混合溶液中的硫酸,是工业上以黄铁矿为原料制备得来的,则需含FeS2质量分数为50%的黄铁矿多少克(设FeS2的转化率为96.0%)?

![]() 高三三月质检化学答题卡
高三三月质检化学答题卡
|
I、选择题(54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
II、非选择题(54分)(请用0.5毫米黑色墨水签字笔书写)
|
请在各题目的答题区域内作答,超出黑色矩形边框限定区域的答案无效
|
请在各题目的答题区域内作答,超出黑色矩形边框限定区域的答案无效
|
请在各题目的答题区域内作答,超出黑色矩形边框限定区域的答案无效
|
请在各题的答题区域内作答,超出黑色矩形边框限定区域的答案无效
请在各题目的答题区域内作答,超出黑色矩形边框限定区域的答案无效
|
请在各题目的答题区域内作答,超出黑色矩形边框限定区域的答案无效
高三三月月考化学参考答案
第I卷 选择题(54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | D | C | B | B | C | C | D | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | D | C | A | B | B | A | D | A |
第
II卷 非选择题(54分)
19、(1)① 吸收水蒸气(2分) 吸收氨气(2分)
② NaOH吸收溶液中水分放热,使溶液温度升高;氢氧根离子浓度增大,都有利于氨气的逸出(共2分,加点处和横线处各1分。其它正确结果参照本标准给分)
③ 黑色粉末变为红色,有无色液滴产生(2分)
(2)①(E)(F)接(D)(C)接(A)(B)[或(B)(A)]接(J)(I)或(H)(G)(2分)
②黑色CuO变红,无水CuSO4变蓝;(2分)
③CuO+CO===Cu+CO2(加热),CO2+Ca(OH)2==CaCO3↓+H2O(每个1分)
20、(1)①4 8 7 8 2 8(2分)②Na2SiO3 + CO2↑(2分)③2NaAlO2 + CO2↑(2分)
(2)AlO![]() + H + + H2O
+ H + + H2O Al(OH)3↓,SiO32-+2H+==H2SiO3↓(每个1分)
(3)2Na2CrO4
+ H2SO4 Na2Cr2O7
+ Na2SO4 + H2O(2分)
21、(1)NO (2分)(2)N2O(2分);反应放热,使溶液温度升高 (2分)
(3)8,30,8,3NH4NO3,9 (2分)
22、
|
4NH3+6NO 5N2+6H2O)(2分)
(2)A:SO2(2分)、B:H2S(2分);2:1(2分)
|
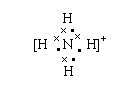
(3)
(2分) 三角锥形(2分),NH![]() +OH-
+OH- NH3↑+H2O(2分)
23、(1)c(H2SO4)= 4.0mol·L-1 (2分) c(HNO3)= 6.0mol·L-1 (2分)
(2) 据3.2g铜粉计算可得:747mL (2分)
(3)5.0g (2分)