高三化学上册期末试卷
班级______姓名______
可能用到的相对原子质量:H 1 C 12 N 14 O 16 K 39 Fe 56
第Ⅰ卷 ( 选择题 共72分 )
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.据报道,用10B合成的10B20有较好的抗癌作用。则下列叙述中正确的是
A.10BF3和CF4一样,分子中各原子最外层均满足8电子结构
B.10B20的中子数和核外电子数相等
C.10B20晶体的熔点高,硬度大
D.10B和10B20互为同位素
2.下列事实与氢键有关的是
A.水结成冰后体积膨胀
B.水加热到很高的温度都难以分解
C.CH4、SiH4、GeH4、SnH4的熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
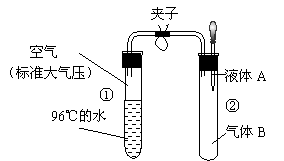 3.如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B组合不可能是下列的
3.如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B组合不可能是下列的
A.NaOH溶液、CO2
B.H2O、NH3
C.NaOH溶液、NO
D.H2O、NO2
[i]
4.(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4==N2↑+6NH3↑+3SO2↑+SO3↑+7H2O。将反应后的混合气体通入BaCl2溶液中,将
A.无沉淀生成 B.生成BaSO4沉淀
C.生成BaSO3沉淀 D.生成BaSO4和BaSO3沉淀
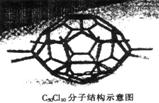 5.厦门大学郑兰荪院士合成了C50Cl10富勒烯足球状分子,如右图,50个碳原子组成若干个正六边形和正五边形,碳均为4价。则有关C50Cl10的说法中不正确的是
5.厦门大学郑兰荪院士合成了C50Cl10富勒烯足球状分子,如右图,50个碳原子组成若干个正六边形和正五边形,碳均为4价。则有关C50Cl10的说法中不正确的是
A.C50Cl10的相对分子质量为955
B.C50Cl10分子中共用电子对数目为105个
C.C50Cl10与C60互为同素异形体
D.C50Cl10分子中含有55个碳碳单键
6.下列有关物质的分类或归类正确的是
①混合物:石炭酸、福尔马林、水玻璃、水银 ②化合物:CaCl2、烧碱、聚苯乙烯、HD
③电解质:明矾、胆矾、冰醋酸、硫酸钡 ④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑤同素异形体:C60、C70、金刚石、石墨
A.①③④ B.③⑤ C.②③④ D.②④
7.下列实验基本操作中正确的是
A.过滤时,玻璃棒靠在三层滤纸边沿稍下方
B.配制一定物质的量浓度的溶液,在移液时玻璃棒轻靠在容量瓶瓶口
C.测定烧杯中溶液的pH时,用pH试纸直接在烧杯中蘸取溶液
D.做Fe与H2O反应的实验时,应用酒精灯外焰对装有铁粉的直通管加热
8.将40oC的饱和CuSO4溶液升温至50oC,或温度仍保持在40oC并加入少量无水CuSO4,在这两种情
况下均保持不变的是
A.硫酸铜的溶解度 B. 溶液中溶质的质量分数
C. 溶液的质量 D. 溶液中Cu2+的数目
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。)
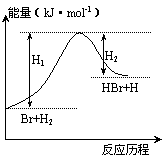 9.参照反应Br+H2→HBr+H的能量对反应历程的示意图判断;下列叙述中正确的是
9.参照反应Br+H2→HBr+H的能量对反应历程的示意图判断;下列叙述中正确的是
A.正反应吸热
B.加入催化剂,该化学反应的反应热不变
C.正反应放热
D.加入催化剂可增大正反应速率,降低逆反应速率
10.某无色溶液与NH4HCO3作用能产生气体,则此溶液中可能大量共存的离子组是
A.Cl—、Mg2+、H+、Zn2+、SO42—
B.Na+、Ba2+、NO3—、OH—、SO42—
C.Ag+、K+、Cl—、H+、SO42— D.MnO4—、NO3—、SO42—、OH—、Na+
 11.始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如右图,其中R1、R2为烷烃基。则下列有关始祖鸟烯的说法中正确的是
11.始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如右图,其中R1、R2为烷烃基。则下列有关始祖鸟烯的说法中正确的是
A.始祖鸟烯与乙烯互为同系物
B.若R1=R2=CH3,则其化学式为C12H16
C.若R1=R2,一定条件下烯烃双键碳原子上的氢也能取代,则始祖鸟烯环上的二氯代物有10种
D.始祖鸟烯既能使酸性高锰酸钾褪色也能使溴水褪色,其褪色原理是一样的
12.下列反应的离子方程式中正确的是
A.铝片跟氢氧化钠溶液反应:Al+2OH—==AlO2—+H2↑
B.澄清石灰水中通入过量二氧化碳:OH—+CO2==HCO3—
C.碳酸钙跟醋酸反应:CaCO3+2CH3CCOH==Ca2++2CH3COO—+H2O+CO2↑
D.醋酸铵溶液跟盐酸反应:CH3COONH4+H+==CH3COOH+NH4+
13.向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,不可能是下图中的
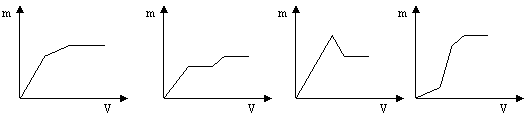 |
A B C D
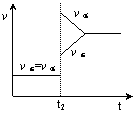 14.往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)
14.往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) ![]() 2HI(g),△H<0,当达到平衡后,t2时改变反应的某一条件(混合气体总物质的量不变),造成容器内压强增大,则下列说法中正确的是
2HI(g),△H<0,当达到平衡后,t2时改变反应的某一条件(混合气体总物质的量不变),造成容器内压强增大,则下列说法中正确的是
A.容器内气体的颜色变深,混合气体的密度增大
B.平衡不发生移动
C.转化率增大,HI平衡浓度变小
D.改变条件前后,速率图像如右图
15.现有等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、
V3 L等浓度的盐酸混合,下列说法中正确的是
A.若混合前三溶液pH相等,将它们同等倍数稀释后,则NaOH溶液pH最大
B.若混合前三溶液pH相等,酸碱恰好完全反应,则V1>V2>V3
C.若混合前三溶液物质的量浓度相等,酸碱恰好完全反应,则V1>V2>V3
D.若混合前三溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2>V3
16.已知当物质的量浓度相同时,碳酸中c(CO32-)比偏铝酸中c(AlO2-)大得多,则下列推论中正确的是
A. 通入适量CO2于AlO2-溶液中,有CO32-生成
B. 含CO32-的溶液容易使Al(OH)3溶解变成AlO2-
C. HCO3-只能与Al3+反应而不能和AlO2-反应
D. NH4+、AlO2-和HCO3-能大量共存于同一溶液中
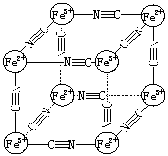 17.某蓝色晶体化学式可表示为:MxFey(CN)z
。用X射线研究其结构
17.某蓝色晶体化学式可表示为:MxFey(CN)z
。用X射线研究其结构
特征如右图所示:Fe2+和Fe3+分别占据立方体的顶点且互不相邻,
而CN— 位于立方体的棱上。则下列说法正确的是
A.该晶体是共价化合物
B.该晶体的化学式可表示为MFe2(CN)6
C.该晶体中既有离子键、又有极性共价键
D.M的离子位于上述晶胞体心,呈+2价
18. 时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域。测定含I-浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度。主要步骤如下:
①在中性溶液中,用溴将试样中I-氧化成IO3-,将过量的溴除去。
②再加入过量的KI,在酸性条件下,使IO3-完全转化成I2。
③将②中生成的碘完全萃取后,用肼将其还原成I-,方程式为:N2H4+2I2==4I-+N2+4H+
④将生成的I-萃取到水层后用①法处理。
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化。
⑥将⑤反应后的溶液以淀粉作指示剂,用Na2S2O3标准液滴定,方程式为:2Na2S2O3+I2==Na2S4O6+2NaI
经过上述放大后,则溶液中I-浓度放大为原溶液中I-浓度的(设放大前后溶液体积
相等): ( )
A.2倍 B.4倍 C.6倍 D.36倍
第Ⅱ卷 (非选择题 共78分)
三、(本题包括2小题,共22分)
19.Ⅰ(8分)某学生往一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一 次):A.KI溶液 B.淀粉溶液 C.NaOH溶液 D.稀H2SO4 E.氯水。发现溶液颜色按如下顺序变化:①无色→②棕黄→③蓝→④无色→⑤蓝。
依据溶液颜色的变化,回答下列问题:
(1)加入以上药品的顺序是(写序号) 。
(2)①→②反应的化学方程式为 。
(3)溶液由棕黄色变为蓝色的原因是 。
(4)③→④反应的化学方程式为 。
Ⅱ、(6分)金属镁是银白色、有金属光泽的活泼金属,但镁带表面呈现灰黑色。用砂纸磨下镁带表面固体粉末,在空气中强热,有水气生成;另取粉末,加入稀酸,产生气体导入澄清石灰水中,产生混浊。如果将灰黑色灰黑色的镁条在纯氧中点燃,燃烧产物中有黑色物质生成。
(1).预测:镁条表面的灰黑色物质的组成是 ;黑色燃烧产物是 。(填名称)
(2).设计实验确定灰黑色物质的具体组成;
________________
(3).说明产生黑色燃烧产物的原因,并设计实验确认该产物成分。
_________________________________________________________________________
20.(8分)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年的《化学教育》报道了如下实验研究:
实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少
 量气泡产生,溶液浅黄绿色褪去;
量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性增强的原因是___________________________ ;
 (2)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有______ ___;
(2)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有______ ___;
实验二、定量研究:
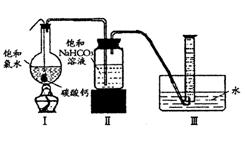
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。请回答:
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成
的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,
最简单的方法是
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现![]() 明显小于
明显小于![]() 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
________
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
________
;
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是_______________________________
_______________ 。
四、(本题包括2小题,共28分)
21.(10分)现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10mL的甲溶液,加入等体积的水,醋酸的电离平衡 移动(填“向左”、“向右”或“不”);另取10mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将 (填“增大”、“减小”或“无法确定”)。 。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲) pH(乙)(填“大于”、“小于”或“等于”)。
(3)各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲) V(乙)(填“大于”、“小于”或“等于”)。
(4)取25mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、
c(CH3COO-)的大小关系为:c(Na+) c(CH3COO-)(填“大于”、“小于”或“等于”)。
22.(10分)(Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:
2A(g)+B(g)![]() 2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
(1)可根据 现象来判断甲、乙都已达到平衡。
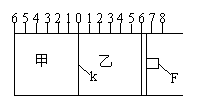 (2)达到平衡时,隔板K最终停留在0刻度左侧a处,
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,
则a的取值范围是 。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量
为 mol,乙中C的转化率 50%(填:>、<、=),此时,乙中可移动活塞F最终停留在右侧刻度 处(填下列序号)① <6 ② >6 ③ =6。
(4)若达到平衡时,隔板K最终停留在左侧刻度靠近0处,则乙中可移动活塞F最终停留在右侧的刻度不大于 ;若K最终停留在左侧刻度靠近2处,则乙中F最终停留在右侧的刻度不小于 。
(Ⅱ)若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)甲、乙中C的物质的量分数是 (填:“甲>乙”或“甲<乙”或“甲=乙” );
(2)测得甲中A的转化率为b,则乙中C的转化率为 ;
(3)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 。
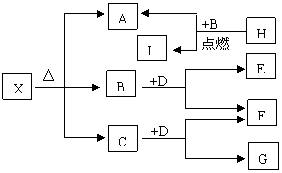 23.(8分)已知X是一种盐,H是常见金属单质,
23.(8分)已知X是一种盐,H是常见金属单质,
F、I是常见的非金属单质,E、G都是工业上
重要的碱性物质,它们有右图所示的关系,
试回答下列问题:
⑴G的化学式为
⑵写出下列反应的化学方程式
①
②
⑶X在医药上用作解酸剂,与盐酸作用时,生成B的物质的量与消耗盐酸的物质的量之比为3:8,则X的化学式为: ,
X与盐酸反应的化学方程式为:
五、(本题包括2小题,共14分)
24. (6分)有机物分子中当有一个碳与四个不同的基团相连接时,该物质具有旋光性。如乳酸(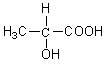 )就有旋光性。
)就有旋光性。
某酯具有旋光性,分子式为C6H12O2。该酯在酸性条件下水解。经分离得相应的酸和醇。
(1) 若生成的酸有旋光性,对应酯的结构简式为______________
(2) 若生成的醇有旋光性,满足此条件的酯有______________种
(3) 该酯经水解后所得水解混合物是否一定有旋光性?_____ ______(要说明原因)
25.(8分)
![]() (1)苯乙酮是一具有香味并有强催泪作用的化学试剂,它的结构简式如右下图所示,则苯乙酮不可能具有的化学性质是
(1)苯乙酮是一具有香味并有强催泪作用的化学试剂,它的结构简式如右下图所示,则苯乙酮不可能具有的化学性质是
A.加成反应 B.取代反应
C.消去反应 D.水解反应
E.银镜反应
 (2) 已知:CH2=CH-CH=CH2与Br2的CCl4溶液发生1︰1加成的时候可以得到BrCH2-CH=CH-CH2Br.和BrCH2-CHBr-CH=CH2二种产物。化合物甲(如右图)能使Br2的CCl4溶液褪色,写出甲与Br2发生等物质的量加成反应时可能产物的结构简式 ____________________ ,
(2) 已知:CH2=CH-CH=CH2与Br2的CCl4溶液发生1︰1加成的时候可以得到BrCH2-CH=CH-CH2Br.和BrCH2-CHBr-CH=CH2二种产物。化合物甲(如右图)能使Br2的CCl4溶液褪色,写出甲与Br2发生等物质的量加成反应时可能产物的结构简式 ____________________ ,
__ , 。
(3) 药用有机化合物A为一种无色液体。从A出发可发生如图所示的一系列反应:
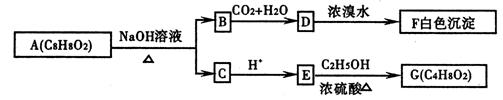
①写出有机物D与浓溴水反应的化学方程式
②写出有机物A与NaOH溶液反应的化学方程式 。
六、(本题包括2小题,共14分)
26.(6分)某天然碱可以看作是CO2和NaOH反应后的产物组成的一种物质。为了测定该物质的成分,进行如下实验:
(1)称取3.32g天然碱样品,加入30mL过量稀盐酸,产生672mL CO2气体(标准状况)。
(2)另称取3.32g天然碱样品,在300℃下加热至分解完全,产生CO2 112mL(标准状况)和0.45g水。
试通过计算,确定天然碱的化学式。
27(8分)有机物A是烃或烃的含氧衍生物,分子中碳原子数不超过6。当0.1 mol A在0.5 mol O2中充分燃烧后,A无剩余。将生成的气体(1.01×105 Pa,110℃下)依次通过足量的无水氯化钙和足量的碱石灰,固体增重质量之比为9:11,剩余气体的体积折算成标准状况为6.72L。试通过计算、讨论确定A可能的化学式。
高三化学期末试卷答案
1.B 2.A 3.C 4.D 5.C 6.B 7.A 8. B
9.AB 10.A 11.C 12.BC 13.D 14.D 15.D 16.A 17.BC 18、D
19
Ⅰ、(1)A→E→B→C→D (2分)
(2)2KI+Cl2==2KCl+I2 (2分)
(3)淀粉遇碘变蓝色 (2分)
(4)I2+2NaOH=NaI+NaIO+H2O (2分)
Ⅱ、1.碱式碳酸镁(1分) 碳(1分)
2.将镁带表面固体粉末在空气中强热,产物先用浓硫酸吸收,再用碱石灰吸收,确定增重质量的比值。(2分)
3.镁与热分解产生的CO2反应(1分)
黑色燃烧产物难溶于稀硫酸中,在浓硫酸中加热溶解,产生刺极性气味气体(1分)
20. (1)CaCO3消耗了氯水中的HCl,使Cl2+H2O![]() HCl+HClO平衡向右移动,HClO浓度增大
HCl+HClO平衡向右移动,HClO浓度增大
(2)Ca(HCO3)2(3)在导管末端再连接长导管,使导管的出口接近量筒底部
(4)碳酸钙与氯水反应生成的Ca(HCO3)2再受热时,除生成CO2外,还生成了CaCO3
(5) 从圆底烧瓶蒸出的水蒸气在广口瓶中冷凝、聚集
21.(共10分,每空2分)
(1)向右 减小 (2)小于 (3)大于 (4)小于
22.(Ⅰ)(1)K、F不再移动 (2)0<a<2 (3)1 > ② (4)8 4
(Ⅱ)(1)甲=乙 (2)1-b (3)![]() <d<
<d<![]()
23.(1)NaOH
![]()
![]() (2)①2Na2O2+2CO2 2Na2CO3+O2 ②2Mg+CO2
(2)①2Na2O2+2CO2 2Na2CO3+O2 ②2Mg+CO2![]() 2MgO+C ③3MgCO3·Mg(OH)2或Mg4(OH)2(CO3)3等; 3MgCO3·Mg(OH)2+8HCl 4MgCl2+3CO2↑+4H2O
2MgO+C ③3MgCO3·Mg(OH)2或Mg4(OH)2(CO3)3等; 3MgCO3·Mg(OH)2+8HCl 4MgCl2+3CO2↑+4H2O
24.(1) ![]() (2) 4
(2) 4
(3)一定有;生成物中有具有旋光性的物质。(其他合理表述也可给分)(每空2分,共6分)
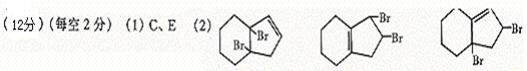
25.
(3)①C6H5OH
+ 3Br2 →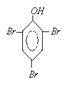 ↓ + 3HBr
↓ + 3HBr
②C6H5OOCCH3 + 2 NaOH → C6H5ONa + CH3COONa + H2O
26.2Na2CO3·NaHCO3·H2O
27.(9分)
(1)CH4(O2过量)
(2)C5H8O或C6H12O5 (每答3分)