08届高三化学下期限时训练(1)
理科综合能力测试(化学)
以下数据可供解题时参考:
相对原子质量(原子量):H 1 C 12 N 14 O 16 Mg 24 Al 27
Na 23 Fe 56
一、选择题
6.背景材料:① 2006年至2008年春节期间,国际原油价格一路飙升;② 不法分子将工业染色剂“苏丹红”混入食用色素;③ 某高速公路发生液氯运输车翻倒泄露事故;④ 2005年诺贝尔化学奖被授予“在烯烃复分解反应研究方面作出贡献”的三位科学家。下列相应说法不正确的是
A.开发太阳能、水能、风能、可燃冰等能源可以缓解油价飙升带来的压力
B.使用一些不能食用的染料给食品染色,有可能引起食物中毒
C.液氯泄露,被转移的人群应立即带上用浓NaOH水溶液浸湿的口罩
D.乙烯、丙烯是重要的有机化工原料,可以通过石油裂解获得
7. 下列说法正确的是
A.物质中存在阴离子就一定存在阳离子
B.正四面体结构的物质其键角均为109°28′
C.同种元素化合价越高,氧化性越强
D.酸式盐的溶解性强于正盐的溶解性
8. 下列有关实验的说法不正确的是
A.淀粉胶体中混有氯化钠杂质,可用半透膜做渗析实验提纯
B.用已被蒸馏水润湿的PH试纸测定未知液的PH时,一定会有误差
C.不用其它试剂即可鉴别稀盐酸和碳酸钠两种无色溶液
D.仅用溴水即可鉴别己烯、苯和四氯化碳
9. 设NA为阿伏加德罗常数,下列说法不正确的是
A.标准状况下22.4LCl2和H2混合气体原子数为2NA
B.1molNa2O2和足量的水完全反应,转移的电子数为NA
C.1mol金刚石中含共价键数目为4NA
D.电解食盐水若产生2g氢气,则转移的电子数目为2NA
![]()
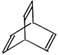 10.有机物的结构可用“键线式”简化表示。如CH3—CH=CH—CH3可简写为
10.有机物的结构可用“键线式”简化表示。如CH3—CH=CH—CH3可简写为 ![]() 。有机物X的键线式为
。有机物X的键线式为
下列说法不正确的是
A.X的化学式为C8H8
B.有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式:
C.X能使酸性的高锰酸钾溶液褪色
D.X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种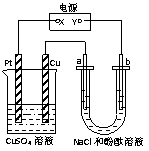
11.对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g);△H<0。下列结论中不正确的是
pC(g)+qD(g);△H<0。下列结论中不正确的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B 的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol
D.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
12.如图所示装置中,a、b都是惰性电极,通电一段时间
后,b极附近溶液呈红色,则下列说法正确的是
A.x是正极,y是负极,CuSO4溶液的pH逐渐减小
B.x是正极,y是负极,CuSO4溶液的pH保持不变
C.x是负极,y是正极,CuSO4溶液的pH 逐渐减小
D.x是负极,y是正极,CuSO4溶液的pH保持不变
13.铜既不溶于稀硫酸,也不溶于NaNO3溶液,但可溶于其混合液。现有2mol/L稀硫酸30mL,往其中加入1.7gNaNO3晶体,充分溶解,该混和液最多可溶解铜的物质的量为
A.0.045mol B.0.03mol C.0.0225mol D.0mol
26.(15分)A、B、C、D为原子序数依次增大的四种短周期元素,A、D同主族,B、C同周期。它们中的两种元素可形成多种原子个数比为1﹕1的化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表:
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 元素种类 | A、B | A、C | A、D | C、D |
通常情况下,甲为气体,密度比空气略小;乙为液体;丙和丁为固体且均为离子化合物。请填写下列空白:
(1)D元素的原子结构示意图为 ,乙的电子式为 ,丁中阴离子与阳离子的个数比为 ;
(2)已知在标准状况下,5.6升的甲完全燃烧放出的热量为325 KJ,试写出表示甲的燃烧热的热化学方程式: ;
(3)研究表明,乙是一种二元弱酸,请写出乙在水中的电离方程式 ;
(4)已知丙的晶体结构与NaCl相似,则该晶体中与D离子距离最近的D离子有 个;有资料显示,丙是一种危险物质,其反应活性很高,在潮湿的空气中能自燃。试解释原因(用化学方程式表示)
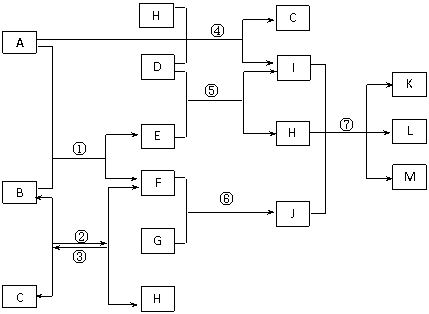 27.(14分)下图表示中学部分常见物质间的相互转化关系,每个字母代表一种物质,每个序号代表一个反应。各步反应的反应物、生成物均已标出,但反应条件均已略去。已知A、F是常见金属单质,C、D、G是氯碱工业上电解K的饱和溶液的产物,L、M分别为白色胶状沉淀和红褐色沉淀。
27.(14分)下图表示中学部分常见物质间的相互转化关系,每个字母代表一种物质,每个序号代表一个反应。各步反应的反应物、生成物均已标出,但反应条件均已略去。已知A、F是常见金属单质,C、D、G是氯碱工业上电解K的饱和溶液的产物,L、M分别为白色胶状沉淀和红褐色沉淀。
回答下列问题:
(1)金属A的化学式为_______,反应①的原理可以应用在生产上,称为_________反应;
(2)反应①~⑦中属于水解反应的是_________________;
(3)工业上电解K的饱和溶液的阳极的电极反应式为___________________________;
(4)写出反应③的化学反应方程式,并标明反应条件___________________;
(5)反应①中,10.8gA的单质与足量B充分反应,可得到F的质量为____________;
(6)反应②③互为可逆反应,试用平衡移动原理解释反应②可以在硬质玻璃管中较彻底进行的原因__________________________________________。
28.(15分)某校化学课外活动小组利用下图装置制备氯化铝固体,并用该固体配制氯化铝溶液。装置中a为长玻璃导管,b为玻璃活塞。实验中可供选用的试剂有:①二氧化锰固体;②铝粉;③氯化钠固体;④浓硫酸;⑤浓盐酸;⑥蒸馏水;⑦碱石灰。资料表明:氯化铝受热至180℃时即升华,在潮湿的空气中易水解。
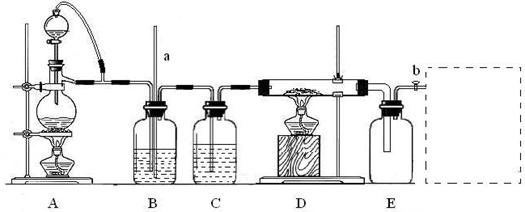
回答下列问题:
(1)检查该装置气密性的方法是___________________________________。
(2)A中气体制备的离子方程式是_________________________。如果可供选择的试剂中无浓盐酸,该小组同学用已供试剂也完成了该实验,则A装置中选用的试剂是____(填序号)。
(3)实验中B装置的作用是_________________________________。
(4)D、E间导管短且粗,原因是___________________________。
(5)用实验制得的氯化铝固体配制溶液的方法是_______________________。
(6)请在E后的虚线框中补充完善该装置。该装置中应盛放的试剂是______(从题中可供试剂中选择,填序号)。
29.(16分)A、B、C、D、E均为有机化合物,转化关系如下:
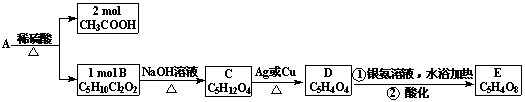
已知:同一个碳原子上不能同时连两个羟基。请回答:
(1)化合物A的分子式__________________
(2)B的结构简式_______________________
(3)写出A→B,C→D的有机反应类型:A→B___________反应 C→D________反应
(4)B不能发生的反应是__________________
①氧化反应 ②取代反应 ③消去反应 ④水解反应 ⑤加聚反应
(5)写出D与足量的银氨溶液在一定条件下反应的方程式
____________________________________________________________
(6)分子式为C5H12O4的四元醇共有_______种。
化学参考答案
| 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| C | A | B | C | D | D | A | B |
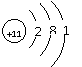 26.(15分)(1)
(1分)
26.(15分)(1)
(1分) ![]() (2分) 1︰2(2分)
(2分) 1︰2(2分)
(2)C2H2(g)
+ ![]() O2(g) = 2CO2(g) + H2O(l); △H = -1300kJ/mol(3分)(若乙炔系数不为1,不得分)
O2(g) = 2CO2(g) + H2O(l); △H = -1300kJ/mol(3分)(若乙炔系数不为1,不得分)
(3)H2O2
![]() H+ + HO2-(1分); HO2-
H+ + HO2-(1分); HO2-![]() H+ + O22-(1分)
H+ + O22-(1分)
(4)12 (2分)
NaH + H2O = NaOH + H2,2H2 + O2 = 2H2O(全对给1+2 = 3分)
[或2NaH + O2 燃烧 2NaOH(3分)]
27.(1)Al (2分) 铝热(2分)
(2)⑦(1分)
(3)2Cl-―2e- = Cl2↑(2分)
(4)3Fe + 4H2O(g) △ Fe3O4 + 4H2(2分)
(5)25.2g(3分)