08届高三化学四月份周测试卷
化 学 2008.4
本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分。共120分。考试用时100分钟。
注意事项:答题前,考生务必将自己的学校、姓名、考试号写在答题卡上。考试结束后,交回答题卡。
可能用到的相对原子质量:H—1 C—12 O-16 Mg-24 Al-27
第I卷(选择题.共48分)
1.月球土壤中吸附着数百万吨的3 2He,每百吨3 2He核聚变所释放出的能量相当于目前人类一年消耗的能量。下列关于3 2He的说法正确的是
A.3 2He原子核内含有2个中子 B.3 2He原子核内含有3个质子
C.3 2He原子核外有3个电子 D.3 2He和4 2He是两种不同的核素
2、下列叙述正确的是
① CO2的大量排放会加剧温室效应② 正常雨水的pH 为5.6,主要是因为溶解了SO2
③ 利用太阳能、风能和氢能替代化石能源能改善空气质量
④ 含磷合成洗涤剂易于被细菌分解,不会导致水体污染
⑤ 为防止电池中的重金属离子污染土壤和水源,废电池要集中处理
A.①②③④⑤ B.②③⑤ C.①③⑤ D.①②④⑤
3、下列叙述正确的是
A.CO和CaO分别属于酸性氧化物和碱性氧化物
B.蒸馏和蒸发分别可以从海水中得到淡水和粗盐
C.自然固氮和人工固氮分别是物理变化和化学变化
D.石油的裂化和煤的干馏得到的产物分别是纯净物和混合物
4、已知M2O2- n可把R2-氧化为R单质,变为M2+。又知c(M2O2- n)=0.3mol/L的溶液100mL,可与c(R2-)=0.6mol/L的溶液150mL恰好完全反应,则n值为
A.7 B.6 C.5 D.4
5、下列叙述正确的是
A.48g O3含有6.02×1023个氧原子 B.常温常压下,11.2L甲烷气体含有3.01×1023个甲烷分子
C.1L 0.1mol·L-1MgCl2溶液中含有2×6.02×1023个离子 D.0.1 mol NH4+离子含有 6.02×1023个电子
6、上海磁悬浮铁路是世界上第一条投入运营的商业磁悬浮铁路。磁悬浮的核心技术是利用超导体的反磁性。以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质YBa2Cu3Ox。现欲合成0.5 mol此高温超导物质,理论上需取Y2O3、BaCO3和CuO的物质的量(mo1)分别为 ( )
A. 0.50、0.50、0.50 B. 0.50、1.0、1.5 C. 0.25、1.0、1.5 D. 1.0、0.25、0.17
7、S(单斜)和S(正交)是硫的两种同素异形体。
已知:① S(单斜,s)+O2(g) == SO2(g) △H1=-297.16 kJ·mol-1
② S(正交,s)+O2(g) == SO2(g) △H2=-296.83 kJ·mol-1
③ S(单斜,s) == S(正交,s) △H3
下列说法正确的是
A.△H3=0.33 kJ·mol-1 B.单斜硫转化为正交硫的反应是吸热反应
C.S(单斜,s) == S(正交,s) △H3<0,正交硫比单斜硫稳定
D.S(单斜,s) == S(正交,s) △H3>0,单斜硫比正交硫稳定
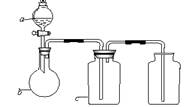 8、下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是
8、下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是
| 编号 | 气体 | a | b | c |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3 |
| C | NO | 稀HNO3 | 铜屑 | H2O |
| D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
二、选择题(本题包括6小题,每小题4分,共24分。每小题有一个或二个选项符合题意。若正确答案包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分)
9、下列化学反应的离子方程式正确的是
A.氢氧化镁中滴加盐酸: H+ + OH-== H2O
B.碳酸氢钙溶液中加入氢氧化钠溶液: HCO3- + OH-== CO32- + H2O
C.金属铝溶于氢氧化钠溶液: 2Al + 6OH- == 2AlO2- + 3H2↑
D.用FeCl3溶液腐蚀铜电路板: 2Fe3++ Cu == 2Fe2++ Cu2+
10、某温度下,已知反应mX(g)+ nY(g) ![]() qZ(g) △H>0,m+ n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是
qZ(g) △H>0,m+ n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是
A.反应速率υ正(X) =![]() υ逆(Y) B.加入X,反应的△H增大
υ逆(Y) B.加入X,反应的△H增大
C.增加Y的物质的量,X的转化率增大 D.降低温度,![]() 的值变小
的值变小
11、甲醇(CH3OH)燃料电池可用于笔记本电脑、汽车等,一极通入甲醇,另一极通入氧气,电池工作时,H+由负极移向正极。下列叙述正确的是
A.氧气为负极 B.甲醇为负极
C.正极反应为:O2+4H++4e-== 2H2O D.负极反应为:CH3OH+H2O+6e- == CO2↑+ 6H+
12、在周期表主族元素中,X元素位于第二周期,且分别与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数;这四种元素原子的最外层电子数之和为20。下列判断正确的是
A.原子序数:Z>Y>X>W
B.X、Y、Z、W形成的单质最多有6种
C.X元素最高价氧化物对应水化物的化学式为:H3XO4
D.四种元素的气态氢化物中,W的气态氢化物最稳定
13、物质X(□)和物质Y(〇)的反应中微粒之间的关系如下图所示,对该反应的描述,下列反应方程式正确的是 ( )
 A. 3X+8Y→X3Y8
A. 3X+8Y→X3Y8
B. 3X+8Y→3XY2+2Y
C. 3X+6Y→X3Y6
D. X+2Y→XY2
 14、
14、
第II卷 (非选择题共72分)
三、(本题包括1小题,共10分)
15.(10分)某品牌消毒液包装说明的部分内容摘录如下:主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉暗处保存。请完成以下实验探究过程:
(一)阅读材料,获取信息
(1)推测该消毒液的酸碱性:________,原因是(用离子方程式表示)________________。
(2)该消毒液还具有的化学性质是_________性和________性。
(3)从该消毒液的保存要求分析,导致其失效的外界因素主要是______________________________。
(二)确定要研究的问题
该消毒液对碳钢制品是否有腐蚀作用?
(三)设计方案,实施探究
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯,浸泡一段时间。对可能产生的现象有如下假设:
假设①:有明显现象;
假设②:无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是___________________________。
(5)基于假设②,结论是___________________________________________,请设计实验进一步验证该结论,叙述实验操作:_____________________________________________________________。
四、(本题包括2小题,共19分)
16.(8分)你留意过标签上的化学吗?
(1)这是某品牌休闲西服标签上的部分内容:
| 等级:特级 成份:面料 羊毛80% 绦纶20% 里料 绦纶100% |
|
| 熨烫标准:中温,不超过150℃ |
回答 ①其中属于合成纤维的是____________
②从此标签中可感觉羊毛、绦纶两种纤维的共同点有________。
③将面料、里料中各抽出一根来点燃,可观察到的现象是_______。
(2)某化肥厂生产的一种化肥,其包装袋上标有:
| 硝酸铵(NH4NO3) 净重 50kg 含氮量≥31.5% |
|
①该厂生产的每一袋这种化肥中NH4NO3的质量应不少于_____kg。
②某些汽车的安全气囊中也装有NH4NO3,它在高温或猛烈撞击时,会迅速反应,产生大量气体,从而避免驾驶员受伤。其原理是:2NH4NO3→2N2↑+O2↑+4H2O↑
③在使用此化肥时,你最想关照农民大哥的事情是 (至少说出两点)。
17、(11分)聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。
本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭土,化学组成为:
 Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:
Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:
根据流程图回答下列问题:
(1)“煅烧”的目的是________________________________________________________。
(2)配制质量分数15%的盐酸需要200mL30%的浓盐酸(密度约为1.15g/cm3)和_______g蒸馏水,配制用到的仪器有烧杯、玻璃棒、______________。
(3)“溶解”过程中发生反应的离子方程式为____________________________________
___________________________________________________。
(4)加少量铝粉的主要作用是_____________________________________。
(5)“调节溶液pH在4.2~4.5”的过程中,除添加必要的试剂,还需借助的实验用品是_________________;“蒸发浓缩”需保持温度在90~100℃,控制温度的实验方法是_________________。
五、(本题包括1小题,共11分)
18、(11分)甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)![]() CH3OH(g) ΔH
< 0。
CH3OH(g) ΔH
< 0。
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡。
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是 _______(填字母)。
A.升高温度 B.增大压强 C.通入CO D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡____________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
作出此判断的理由是____________________________________________________
__________________________________________________________________________________。
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。实验数据见下表:
| CO2%-CO%-H2% (体积分数) | 0–30–70 | 2–28–70 | 4–26–70 | 8–22–70 | 20–10–70 | |||||||||||
| 反应温度/℃ | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | |
| 碳转化率(%) | CH3OH | 4.9 | 8.8 | 11.0 | 36.5 | 50.7 | 68.3 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 | 8.0 | 12.0 | 22.6 |
| CH4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2.8 | 2.8 | 2.8 | |
(3)由上表数据可得出多个结论。
结论一:在一定条件下,反应温度越高,碳转化率__________。
结论二:_______________________________________________________________
____________________________________________________________________。
(4)为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验。
| 组别 | 体积分数(%) | |||
| CO | CO2 | H2 | N2 | |
| 第1组 | 19.7 | 0.0 | 59.1 | 21.2 |
| 第2组 | 20.7 | 0.3 | 62.1 | 16.9 |
| 第3组 | 16.9 | 1.3 | 50.7 | 31.1 |
| 第4组 | 19.8 | 5.5 | 59.4 | 15.3 |
| 第5组 | 20.3 | 10.9 | 60.9 | 7.9 |
进行该验证实验时,控制不变的因素有________________、_________________、____________________________________________等。
六、(本题包括1小题,共10分)
19、(10分)一氯乙酸(ClCH2COOH)是无色晶体,可溶于水,其水溶液显酸性,是重要的有机反应中间体,可进行多种反应。
(1)一定条件下,一氯乙酸与苯可直接合成苯乙酸,其反应方程式是______________________ (不要求标出反应条件)。
(2)工业上将一氯乙酸、2–丙醇与浓硫酸混合加热制备一氯乙酸异丙酯,一氯乙酸异丙酯的结构简式为____________________________________ ;反应过程中,可能产生的有机副产物有异丙醚[(CH3)2CHOCH(CH3)2]和________________________(填结构简式)。
(3)pKa常用于表示物质的酸性强弱,pKa的数值越小,该物质的酸性越强。已知卤素原子对饱和脂肪酸的酸性影响具有相似性。25℃时一些卤代饱和脂肪酸的pKa数值如下:
| 卤代酸 | F3CCOOH | Cl3CCOOH | F2CHCOOH | FCH2COOH |
|
| pKa | 0.23 | 0.65 | 1.24 | 2.66 | 2.85 |
| 卤代酸 | ClCH2COOH | BrCH2COOH | ICH2COOH |
| CH2CH2CH2COOH |
| pKa | 2.86 | 2.90 | 3.18 | 4.06 | 4.52 |
可见,25℃时卤素原子对卤代饱和脂肪酸的酸性影响有(写出2条即可):
①___________________________________________________________________;
②____________________________________________________________________;
根据上述数据和规律判断, Cl2CHCOOH的pKa的数值范围为_________________。
七、(本题包括1小题,共10分)
20. 某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种。已知甲、乙及CO、H2的燃烧热如下:
| 物质 | 甲 | 乙 | CO | H2 |
| 燃烧热/kJ·mol-1 | 1366 | 5518 | 283 | 286 |
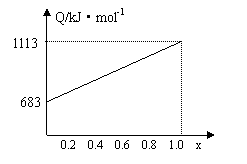 取甲、乙按不同比例混合的燃油23g,在足量的O2中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如右图。试求:
取甲、乙按不同比例混合的燃油23g,在足量的O2中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如右图。试求:
⑴ 乙的相对分子质量Mr(乙) ;
⑵ 160g由甲、乙等物质的量混合而成的燃油
在347.2LO2中恰好完全燃烧,得492.8L气体,冷却到室温时,还剩余224L(气体体积均在标准状况下测定)。由此可求得混合物中C、H、O的原子个数比 。
甲、乙的分子式为:甲 ;乙 。
⑶1mol由甲、乙等物质的量混合而成的燃油在一定量的O2中燃烧,放出热量2876kJ·mol-1,则反应中生成CO mol。
八.《物质结构与性质》(12分)
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)砷原子核外电子排布式为________________________________________。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为_________________,该化学键能够形成的原因是_______________________________________________________________。
(3)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
分析上表中四种物质的相关数据,请回答:
① CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是______________________________。
② CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是___________________
____________________________________________
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时________先液化。
班级 姓名 学号 成绩
08届高三周测试卷化学试题答题纸
第Ⅰ卷(选择题,共48分)
一、二选择题(1—8题为单项选择题;9—16题为1-2个正确答案的选择题)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答 案 | ||||||||
| 题 号 | 9 | 10 | 11 | 12 | 13 | 14 |
| |
| 答 案 |
| |||||||
三、(本题包括1小题,共10分)
15.(10分) (一)(1):________, _ ___________ ____。
(2)_________和________。(3)_________________________ _____。
(4)___________________________ ______ ______。
(5)______ ___________________________________________,
:_____________________________________________________________。
四、(本题包括2小题,共19分)
16.(8分)①____________ ②________。 ③_______。
(2)①_____kg。③______ ______ (至少说出两点)。
17、(11分)
(1)________________________________________________________。
(2)_______;______________。
(3)“____________________________________;
___________________________________________________。
(4)_____________________________________。
(5)_________________; _________________。
五、(本题包括1小题,共11分)
18、(11分)
Ⅰ.(1) _______(填字母)。(2)____________(填字母)。
____________________________________________________
__________________________________________________________________________________。
Ⅱ.
(3)_________ _。
:_______________________________________________________________
____________________________________________________________________。
(4)________________、_________________、____________________________________________等。
六、(本题包括1小题,共10分)
19、(10分)
(1)______________________ (不要求标出反应条件)。
(2)____________________________________ ;和________________________(填结构简式)。
(3)(写出2条即可):
①___________________________________________________________________;
②____________________________________________________________________;
根据上述数据和规律判断, Cl2CHCOOH的pKa的数值范围为_________________。
七、(本题包括1小题,共10分)
20. ⑴ ;⑵ 。
甲 ;乙 。 ⑶ mol。
八.《物质结构与性质》(12分)
(1)________________________________________。
(2)_________________,_______________________________________________________________。
(3)
①
_________________________________________________________________________________________
______________________________________________________________________。
②
_________________________________________________________________________________________
____________________________________________________________________。
________先液化。
08届高三周测试卷答案
1-8DCBADCCB 9--14D AC BC A D CD
15(12分)
(1)碱性(1分)
ClO-
+ H2O ![]() HClO + OH-
(2分)
HClO + OH-
(2分)
(2)氧化性 漂白性 不稳定性 (任写两个,每空1分)
(3)CO2等酸性气体、光和热 (2分)
(4)铁钉表面出现铁锈(或红褐色固体) (1分)
(5)铁钉可能未被腐蚀,也可能被腐蚀但无明显现象 (1分)
用试管取出少量浸泡后的溶液,滴加足量的稀硫酸酸化,再滴加几滴KSCN溶液。(3分)
16(10分)(1)①绦纶(1’) ②不耐高温(1’),有可燃性(1’) ③羊毛灼烧时有烧焦羽毛的气味,而绦纶无此现象(1’)
(2)①45(2’) ③a. 若化肥结块,不能用硬器敲击(1’) b. 不要与草木灰等碱性物质共施(1’)
17(11分)
(1)改变高岭土中氧化铝的结构,使其能溶于酸。(2分)
(2)230(1分) 量筒(1分)
(3)Al2O3+6H+ == 2Al3++3H2O(2分) Fe2O3+6H+ == 2Fe3++3H2O(2分)
(4)除去溶液中的铁离子(1分)
(5)pH计(或精密pH试纸)(1分) 水浴加热(1分)
18、(11分)(1)BD(2分)(选对1个给1分,选错1个倒扣1分,但不出现负分。)
(2)C (1分) 该反应达到平衡时,平衡常数K=![]() ,增大容器体积时,c(CH3OH)和c(CO)等比例减小,由于H2浓度不变,此时
,增大容器体积时,c(CH3OH)和c(CO)等比例减小,由于H2浓度不变,此时![]() 的值仍然等于K,所以平衡不移动。(2分)
的值仍然等于K,所以平衡不移动。(2分)
(3)越高(1分) 原料气含少量CO2有利于提高生成甲醇的碳转化率,CO2含量过
高碳转化率又降低且有甲烷生成。(2分)
(4)温度 压强 CO和H2的体积分数之比 (每空1分)
![]() 19、(10分)
19、(10分)
(1)ClCH2COOH + → (2分)
(2)ClCH2COOCH(CH3)2 (1分) CH3CH=CH2 (1分)
(3)① 一卤代乙酸的酸性按F、Cl、Br、I的顺序依次减弱。
② 含有相同卤素原子的卤代乙酸的酸性随卤素原子个数的增多而增强。
③ 卤素原子离羧基越远,一卤代饱和脂肪酸的酸性越弱。(任写两个,每空2分)
2.86~0.65(或2.86~1.24) (2分)
20、![]() (10分)解:
(10分)解:
⑴ Mr(乙)= ;(2分)
⑵ 设n(甲)=n(乙)=x,则46x+114x=160,x=1mol
![]() 消耗O2 =
15.5 mol,恰好完全燃烧,生成n(CO2 )=10 mol,
消耗O2 =
15.5 mol,恰好完全燃烧,生成n(CO2 )=10 mol,
生成n(H2O ) = 12 mol
所以混合物中碳、氢、氧的原子个数比为:N(C)︰N(H)︰N(O)=10︰24︰(20+12-31)= 10︰24︰1 (2分)
![]() 甲:C2H6O;(2分) 乙:C8H18 ;(2分)
甲:C2H6O;(2分) 乙:C8H18 ;(2分)
⑶甲、乙等物质的量混合而成的1mol燃油完全燃烧放出的热量= 3442kJ
现在放出热量为2876kJ,少放出3442kJ-2876=566kJ。说明反应中生成了2molCO。(2分)
21、(1)1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 (2分)
(2)配位键(2分)CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道)(2分)
(3)① 结构相似时,相对分子质量越大,分子间作用力越大,因此SiH4沸点高于CH4 ;NH3分子间还存在氢键作用,因此NH3的沸点高于PH3。 (2分)
② C-H键键能大于Si-H键,因此CH4分解温度高于SiH4;N-H键键能大于P-H键,因此NH3分解温度高于PH3。 (2分)