2008届高三化学实验题练习一(12.24-30)
1、(10分)为节省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO4溶液;直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器(用品),以巧妙的构思,“接力”的方式,设计了比较铜与锌金属活动性相对强弱的系列实验。试填写下列空白:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜、锌不接触),小心向烧杯中加入稀硫酸,观察到的现象是__________________________________________。甲同学设计思路_________________________________________________________________________________________________
(2)乙同学接着甲的实验,向烧杯中滴加__________________溶液,进而观察到的现象是________________________________,__________________________。乙同学作出锌、铜金属活动性相对强弱所依据的原理是_____________________________________________________________
___________________________________________________________
(3)丙同学使用直流电源和石墨电极组装电解装置,向乙同学实验后的溶液中补充了必要的试剂(作电解液)。反应在调控下开始,有关电化学反应的化学方程式为________________________ __。获得的明显实验现象____________________________________________
___________________________________________________________
(4)请你再单独设计一个简单实验(试剂、仪器自选),证实锌和铜金属活动性的相对强弱(简要说明操作、现象)。__________________________________________________________
___________________________________________________________
2、(12分)用下图装置进行SO2转化为SO3的转化率测定实验:2SO2+O2 ![]() 2SO3 △H=-196.6kJ/mol
2SO3 △H=-196.6kJ/mol
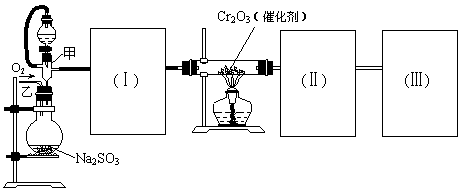
(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接1个合适的装置,请从下列A~E中选择适宜的装置,将其序号填入空格内。
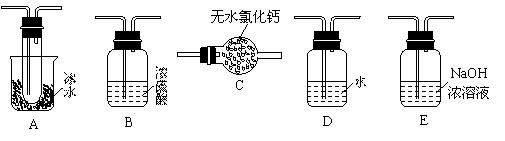
Ⅰ 、Ⅱ 、Ⅲ 。
(2)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(3)实验时,浓硫酸能顺利滴入烧瓶中,甲装置所起作用的原理是:
。
(4)从乙处均匀通入O2,为使SO2有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 。
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是 若用大火加热有Cr2O3处的反应管时,SO2的转化率会 (填升高、降低或不变)
(6)实验时若用25.2g的Na2SO3,加入的浓硫酸是足量的,反应结束时继续通入O2一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中SO2的转化率为 。(保留3位有效数字)
3.(12分)下面是甲、乙两同学对草酸受热分解及其产物的检验做的探究:
甲、乙两同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
| 名称 | 分子式 | 颜色、状态 | 溶解性 | 熔点(℃) | 密度(g/cm3) | |
| 草酸 | H2C2O4 | — | 易溶于水 | 189.5 | 1.900 | |
| 草酸晶体 | H2C2O4·2H2O | 无色晶体 | — | 101.5 | 1.650 |
备注:草酸晶体失去结晶水后,175℃以上开始分解。
(1) 猜想与假设:
第一种:草酸分解产物是CO2和H2;
第二种:草酸分解产物是CO2、CO和H2O;
第三种:草酸分解产物是CO2和H2O。
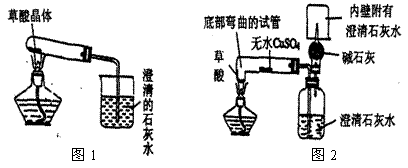
(2) 实验装置的设计(图中铁架台略去)甲同学设计了如图1所示的装置。乙同学设计了如图2所示的装置。
 |
(3) 实验:
甲同学按图(1)装置实验,观察到澄清石灰水变浑浊,……
乙同学按图(2)装置实验,观察到:
A、无水CuSO4变蓝;
B、广口瓶中澄清石灰水变浑浊;
C、生成的气体通过碱石灰后,在尖嘴处点燃后能燃烧,在火焰上方罩一个内壁附有澄清石灰水的烧杯,澄清的石灰水变浑浊。证明产物中有 。
(4) 结论:
第 种猜想是正确的,请写出草酸受热分解的化学反应方程式
。
(5) 反思与评价
乙同学认为甲同学设计的实验装置有缺陷。由于试管口向下倾斜,而且草酸晶体熔点较低,加热到182℃便开始熔化,因此实验中常会出现熔融的草酸流进导管而影响后续实验。甲同学认为乙同学的设计是科学合理的。请你谈谈图2装置优于图1装置之处:
第一点: 。
第二点: 。
第三点: 。
。
乙同学设计的图2装置也能证明产物中无H2,证明方法是
。
4、(10分)实验室有CuO和Cu粉的混合物。请你利用给出的实验仪器及试剂,设计两种测定该样品(已称得其质量为m克)中氧化铜质量分数的方法,并填写表格中的有关内容。
| 实验 方法 | 实验过程中所发生反应的 化学方程式 | 实验所用仪器 (用编号表示) | 实验需直接测定的有关物理量 (用文字说明) |
| 1 | ] | ||
| 2 |
实验可能用到的主要仪器:
①托盘天平 ②启普发生器 ⑧硬质玻璃管 ④泥三角 ⑤烧杯
⑥坩埚 ⑦酒精灯 ⑧玻棒 ⑨漏斗 ⑩干燥管
实验可能用到的试剂:
a.锌粒 b.稀硫酸 c.氯化钠溶液 d,浓硫酸
5、、(12分)乙醛是一种常用的有机试剂,也象葡萄糖一样在碱性和加热条件下,能与银氨溶液反应析出银。如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,因此这个反应又叫银镜反应。银镜的光亮程度与反应条件有关。同学们在课外活动中对乙醛的银镜反应进行了探究。
Ⅰ、探究银镜反应的最佳实验条件
部分实验数据如下表:
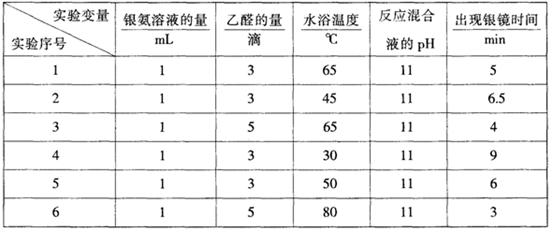
请回答下列问题:
(1)读表 若只进行实验1和实验3,其探究目的是 。
(2)推理 当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11时,出现银镜的时间是 ;要探索不同水浴温度下乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成的银镜的 。
。
(3)进一步实验 若还要探索银氨溶液的用量对出现银镜快慢的影响,如何进行实验?
。
Ⅱ、探究对废液的回收处理
银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。通过查找资料,已知从银氨溶液中提取银的一种实验流程为:

操作④的方法是:把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉。反应的化学方程式为:Ag2S+Fe+2HCl2 Ag+ FeCl2+H2S↑
(4)若获得的银粉中含有少量没有反应完的铁粉,除去铁的反应的离子方程式为 ,
需要用到的玻璃仪器有 (填编号)。
(5)操作④应在(填实验室设备名称) 中进行。
(6)要洗去试管壁上的银镜,采用的试剂是 (填名称)。
2008届高三化学实验题练习一(12.24-30)
1、(10分)(1)锌片表面有气泡产生。在金属活动性顺序中,锌排在氢的前面,可与稀硫酸反应,铜排在氢的后面,不与稀硫酸反应。
|
(3)2CuSO4+2H2O===2Cu+O2↑+H2SO4;阳极产生无色气体、阴极石墨表面产生红色固体。
(4)取两片相同的铁片,分别放入盛有ZnSO4溶液、CuSO4溶液的两支试管中,观察铁片表面的变化。(其它合理答案均可)
2、(共12分)
(1)Ⅰ:B Ⅱ:A Ⅲ:E (各1分,共3分)
(2)检查装置的气密性 (1分)
(3)保持分液漏斗内压强与烧瓶内压强相等 (1分)
(4)先加热催化剂,然后缓慢滴加浓硫酸 (1分)
(5)温度过高不利于SO3的生成,且影响催化剂的活性。 (2分) 降低 (1分)
(6) 70.5% (3分)
3、(共12分)
|
(4)第二种,H2C2O4 == CO2↑+ CO↑+ H2O (3分)
(5)第一点:底部弯曲的试管避免了熔化的草酸流进导管。(2分)
第二点:乙同学设计的装置可同时证明CO2、CO、H2O的存在。 (2分)
第三点:乙同学的设计在验证了CO存在的同时又解决了CO的污染问题。(2分)
方 法:在球形干燥管的尖嘴处点燃通过碱石灰干燥后导出的气体(或点燃尖嘴处的气
体),并在火焰上方罩一冷而干燥的小烧杯,烧杯内壁无水雾,证明无H2。(2分)
4(10分)
| 实验方法 | 实验过程中所发生 | 实验所用仪器 (用编号表示) | 实验需直接测定的有关物理量 (用文字说明) |
| 1 | H2SO4+Zn=ZnSO4+H2↑ H2+CuO=Cu+H2O | ①②③⑦ | 实验前样品和硬质玻璃管的总质量(或硬质玻璃管的质量) 实验后Cu及硬质玻璃管的总质量 |
| 2 | H2SO4+CuO=CuSO4+H2O | ①⑤⑧⑨ | 过滤后剩余固体的质量 |
| 3 | 2Cu+O2=2CuO | ①④⑥⑦⑧ | 实验前坩埚与样品总质量 (或坩埚质量) 实验后坩埚与CuO总质量 |
(以上三种方法任选两种,其它合理的方法也给分)
5、(共12分)
(1)比较乙醛用量不同时生成银镜的时间(速度或质量均可)(2分)
(2)在6.5~9min之间;光亮程度(或亮度、外观、效果等,合理均可给分)(各1分,共2分)
(3)保持其他的实验条件不变,改变银氨溶液的用量,测量生成银镜的时间。(合理的表述均可给分)(2分)
(4)Fe+2H+==Fe2++H2↑(2分)(其他合理答案也可给分,如Fe+2 Fe3+==3Fe2+);
bef(2分)
(5)通风橱(1分) (6)硝酸(1分)