08届高三化学第一次调研考试试题
由武汉市教科院 赵莉老师提供
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共6页,共108分.考试时间为90分钟.
第Ⅰ卷(选择题 48分)
注意事项:
⒈第Ⅰ卷的每小题有四个选项,其中只有一个选项符合题意.
⒉每小题选出答案后,用钢笔或圆珠笔将答案对应填在答题卷的“选择题答题表”中.
可能用到的相对原子质量:H-1 C-12 O-16 N-14 Na-23 Al-27 Fe-56 Ag-108
一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个正确答案.)
1.武汉80万吨乙烯工程的奠基,标志我国中部地区最大的化工原料基地即将诞生.下列不属于乙烯用途的是( )。
A.代替天然气等作燃料 B.合成聚乙烯等塑料
C.制取乙醇 D.制造合成纤维
2.下列反应中生成物的总能量高于反应物的总能量的是( )。
A.氢氧化钠溶液与盐酸中和 B.铝粉与氧化铁反应
C.乙炔的燃烧 D.碳酸氢钠受热分解
3.目前,人类已经发现的非金属元素除稀有气体元素外有16种,下列对这16种非金属元素的判断不正确的是( )。
①原子的最外层电子数都大于3;
②单质在反应中都只能作氧化剂;
③对应的含氧酸都是强酸;
④氢化物常温下都是气态,所以又叫气态氢化物.
A.只有①② B.全部 C.只有①②③ D.只有①②④
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )。
A.1.8 g 重水(D2O)中含有的中子数为NA
B.常温常压下,22.4 L O2 含有的分子数为NA
C.1 L 1 mol/L FeCl3溶液中含有Fe3+的数目为NA
D.0.1 mol CO2分子中含有的共用电子对的数目是0.4 NA
5.关于下列各装置图的叙述中,不正确的是( )。
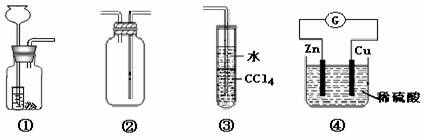
A.装置①可用于制取H2、CO2
B.装置②可用于收集H2、HCl、NO等气体
C.装置③可用于吸收剩余NH3或HCl,能防止倒吸
D.装置④中电子由Zn片经过电流计G流向Cu片
6.下列说法正确的是( )。
A.中和滴定时,滴定管和锥形瓶使用前要先用待装液润洗2~3次
B.乙酸乙酯收集时,将导管插入饱和的碳酸钠溶液中
C.在电泳实验中,Fe(OH)3胶体粒子在电场作用下向阴极移动
D.用湿润的pH试纸可测得某硫酸的pH
7.下列条件下,两瓶气体所含原子数一定相等的是( )。
A.同质量、同体积的C2H4和C3H6
B.同温度、同体积的N2和H2
C.同体积、同密度N2和NO
D.同体积、同压强的N2O和CO2
8.下列有关化学用语的使用正确的是( )。
A.丙烯的结构简式为:CH3CH=CH2
B.氨分子的空间构型为:正四面体
C.用食醋除水垢的离子方程式为:CaCO3+2H+ =Ca2+ +CO2↑+H2O
D.表示氢气燃烧热的热化学方程式为: 2H2(g)+ O2(g)= 2H2O(g);△H = -483.6 kJ/mol
9.下列三种有机物互为同分异构体,其中能与NaHCO3反应放出CO2的是( )。
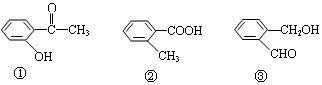
A.只有① B.只有② C.①和② D.①②③
10.恒容容器甲与恒压容器乙开始时的体积相同,均盛有2 mol SO2和1 mol O2的混合气体,经一定时间反应,在相同温度下达到平衡.有关平衡时的叙述正确的是( )。
A.甲、乙中SO2的体积分数相同
B.甲中的反应速率比乙中快
C.乙中SO2的转化率比甲中高
D.若甲、乙中皆再加入同量的氩气,平衡不移动
11.有FeO、Fe2O3的混合物若干克,在足量H2流中,加热充分反应后,冷却后称得剩余固体比原混合物减轻0.8 g;若将等质量的原混合物与盐酸反应,欲使之完全溶解,需1 mol/L的盐酸的体积至少为( )。
A.0.05 L B. 0.1 L C.0.2 L D.1 L
12.C3N4和Si3N4晶体结构相似,是新型的非金属高温结构陶瓷.下列说法正确的是( )。
A.C3N4和Si3N4中N的化合价为+3 B.C3N4和Si3N4易与水反应生成NH3
C.C3N4和Si3N4中含有共价键 D.C3N4晶体的硬度比Si3N4晶体的小
13.右表为元素周期表短周期的一部分.下列有关W、X、Y、Z四种元素的叙述中,正确的是( )。
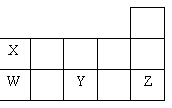 A.YO2能使紫色石蕊试液先变红后褪色
A.YO2能使紫色石蕊试液先变红后褪色
B.将W的氧化物溶于水可得W的含氧酸
C.X的氢化物沸点比W的氢化物的沸点高
D.Y的阴离子电子层结构与Z原子的相同
14.下列叙述正确的是
A.0.1 mol/L氨水中,c(OH-) = c(NH4+)
B.0.1 mol/L NH4Cl溶液中,c(H+) = c(NH3·H2O)+c(OH-)
C.0.1 mol/L NaHCO3溶液中,c(Na+)=2 c(CO32-)+c(HCO3-)+c(H2CO3)
D.0.02 mol/L 盐酸与0.02 mol/L Ba(OH)2溶液等体积混合后,溶液的pH=13
15.1.6 mol由NO和NH3组成的混合气体,在催化剂作用下于400℃左右可发生
6NO+ 4NH3 ![]() 5N2+6H2O,达到平衡后,在相同条件下混合气体的物质的量变为1.7
mol.则被氧化N的物质的量为( )。
5N2+6H2O,达到平衡后,在相同条件下混合气体的物质的量变为1.7
mol.则被氧化N的物质的量为( )。
A.0.3 mol B.0.4 mol C.0.6 mol D.0.8 mol
16.下列说法中,正确的是( )。
A.当今化学研究的方向是化学反应中原子守恒关系
B.绿色食品中不含有任何化学物质
C.石油所含主要的元素是碳、氢、氧
D.闪电时,氧气既能生成臭氧,又能与氮气化合
第Ⅱ卷(非选择题 60分)
二、(本题包括5小题,共60分)
17.(8分)
向20 mL氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示:
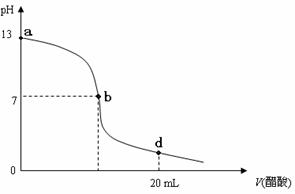
⑴该氢氧化钠溶液的物质的量浓度为 .
⑵在b点,c(Na+) c(CH3COO-)(填“>”、“<”或“=”) .
⑶氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线的 (填选项的编号)
A. a点 B.b点 C.d点 D.a、b间的某点 E.b、d间的某点
⑷在d点,溶液中所有离子浓度由大到小的顺序为: ____ .
18.(12分)
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大.A的原子核无中子,能与B、C分别形成10电子的化合物;B、C的质子数之和与E的质子数相等,B、C的族序数为奇数;D、E位于同一周期,D的阳离子所带的正电荷数等于该阳离子的电子层数.试回答下列问题:
⑴C与D形成的化合物的电子式 .
⑵写出C的单质与水反应的化学方程式 .
⑶“嫦娥一号”发射所用的液体燃料是上述 (填元素名称)元素的单质.
⑷工业上,使元素E的低价氧化物转化为其最高价氧化物的设备名称为 .
⑸在一定的条件下,A2、B2混合物经过一段时间的反应后,B2的浓度减小了0.3 mol/L,此时间内A2表示的化学反应速率为0.45 mol/(L·s) .则此段反应时间为 s .
19.(10分)
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根椐上述实验填空:
⑴写出B、D的化学式:B ,D .
⑵将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为 .
⑶在A溶液中加入少量澄清石灰水,其离子方程式为 .
⑷C常用作净水剂,用离子方程式表示其净水原理 .
20.(18分)
现有A、B、C、D、E五种物质,并存在如下转化关系.其中E为黑色粉末,在下图转化中均作催化剂.
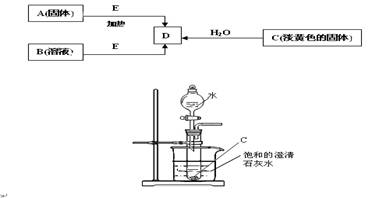
⑴B的化学式 .
⑵利用右图所示的实验装置进行C与水的反应,回答下列有关问题:
①固体C与水反应生成D的化学方程式为: .
②检验导管出口气体的方法为: .
③烧杯中的现象为: .
⑶在加热条件下,某无氧酸(含有A中的一种元素)的浓溶液与E反应,生成单质气体X.为检验X的性质,设计如下图所示实验装置:
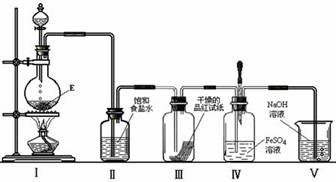
①实验过程中,观察到装置Ⅲ中的品红试纸的红色褪去,并未观察到“无明显变化”这一预期现象.为了达到这一预期现象,你认为应该如何改进?
.
②实验结束后,装置Ⅳ中可观察到现象是 ,若滴加两滴胶头滴管中的试剂,观察到溶液呈血红色,有关的离子方程式为:
___ ______ , .
③X是一种重要的化工原料,用化学方程式表示X在化工生产上的一项用途:
.
21.(12分)
将羧酸的碱金属盐溶液电解可得到烃类化合物.例如:
2CH3-COOK + 2H2O ![]() CH3-CH3↑ + 2CO2↑ + H2↑+ 2KOH
CH3-CH3↑ + 2CO2↑ + H2↑+ 2KOH
请根据如下转化关系(其中部分产物已略去)完成下列问题:
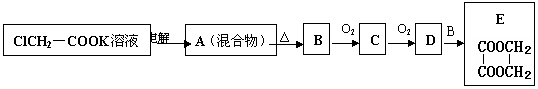 ⑴电解Cl-CH2COOK溶液的阳极反应为
.
⑴电解Cl-CH2COOK溶液的阳极反应为
.
⑵A→B的反应类型是 .
⑶B与O2反应生成C的反应条件为 .
⑷将一定量的有机物C与足量银氨溶液反应,可得到10.8 g Ag.若将等质量的有机物C完全燃烧,标准状况下,生成气体的体积为 .
⑸D和B在不同条件下反应,会生成多种不同产物.请写出生成最小链状产物化学方程式: .
高三年级元月调研考试化学参考答案及评分细则
第Ⅰ卷 选择题答题表(48分)(每题3分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | D | B | D | B | C | A | A |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | B | C | B | C | D | B | B | D |
第Ⅱ卷 非选择题答题处(60分)
17.(8分)(每空2分)
⑴ 0.1 mol/L ⑶ D
⑷ c (CH3COO- ) >c (Na+) > c (H+)> c (OH – )
18.(12分)
![]() ⑶ 氢
(2分) ⑷
接触室 (2分) ⑸
2 (4分)
⑶ 氢
(2分) ⑷
接触室 (2分) ⑸
2 (4分)
19.(10分)(每空2分)
⑴ KNO3 CuSO4 ⑵ Na2CO3 (或“碳酸钠”,填“Na2CO3·10 H2O”不得分)
⑶ 2HCO![]() + Ca2+ + 2OH- = CaCO3↓+CO
+ Ca2+ + 2OH- = CaCO3↓+CO![]() + H2O
+ H2O
⑷ Al3+ + 3H2O
![]() Al(OH)3 + 3H+
Al(OH)3 + 3H+
20.(18分)(每空2分)
⑴ H2O2
⑵ ① 2Na2O2 + 2H2O = 4NaOH + O2↑
② 用带火星的木条靠近导管出口,观察木条是否复燃。(或“用排水集气法收集一试管气体,用带火星的木条伸入试管中,观察木条是否复燃。”)
③ 出现浑浊(或“产生白色沉淀”)
⑶ ① 在装置Ⅱ、Ⅲ之间加入一个盛有浓硫酸的洗气瓶
② 溶液由浅绿色变为黄色
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
Fe3+ + 3SCN- = Fe(SCN)3 (其他合理的写法均可)
③ H2 + Cl2 ![]() 2HCl
(写“光照”不得分)
2HCl
(写“光照”不得分)
或2Cl2 + 2Ca(OH)2 = Ca(ClO)2 + CaCl2 + 2H2O
或CH2=CH2 + Cl2 → CH2Cl-CH2Cl
![]() (其他合理的答案均可)
(其他合理的答案均可)
21.(12分)
⑴ 2Cl-CH2COO- - 2e- = Cl-CH2—CH2-Cl + CO2↑(2分)(这里用“=”或“→”均给分)
⑵ 取代反应(或水解反应) (2分)
⑶ 催化剂、加热(2分)
(或“Ag、加热”,或“Cu、加热”,或“Cu或Ag、加热”,或“CuO、加热”)
⑷ 1.12 L (3分)
⑸
HOOCCOOH +HOCH2CH2OH ![]() HOOCCOOCH2CH2OH
+ H2O (3分)
HOOCCOOCH2CH2OH
+ H2O (3分)