08届高三化学第二学期第一次月考试题
2008-2-27
5、下列各种说法正确的是
A.分解、潮解都是物理变化;风化、酯化都是化学变化
B.NH3分子间易形成氢键;H、Cl原子之间易形成极性共价键
C.用电解法可以制得Na、Al;用热还原法可以制得Ag、Hg
D.臭氧的体积分数超过10~14%的空气有利于人体的健康
6、设NA为阿伏加德罗常数,下列叙述中正确的是
A.14g乙烯和丙烯的混合物中总原子数为3NA个
B.18 g D2O中含有的质子数目为10NA
C.1 L0.5mol/LNa2CO3 溶液中含有的CO32-数目为0.5NA
D.5.6g铁与足量的稀硫酸反应失去电子数为0.3NA个
7、下列有关溶液中微粒的浓度关系表达不正确的是
A.0.1 mol/L HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1 L 0.l mol/LCuSO4·(NH4)2SO4·6H2O的溶液中:
c(SO42-)>c(NH4+) >c(Cu2+)>c(H+)>c(OH-)
C.若Na2CO3溶液与CH3COONa溶液的pH均为9,则CH3COONa溶液的物质的量浓度的大
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>(OH-)
8、室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是
A.NH4+、Cu2+、Cl-、NO3 - B.K+、Na+、SO32-、S2-
C. Ba2+、Fe2+、NO3-、Br- D. K+、Na+、AlO2-、SO42-
9、三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:C3N3(OH)3![]() 3HNCO;8HNCO+6NO2
3HNCO;8HNCO+6NO2![]() 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是
A.C3N3(OH)3与HNCO为同一物质
B.HNCO是一种很强的氧化剂
C.1 molNO2在反应中转移的电子为4mol
D.反应中NO2是还原剂
10、下列有关实验的说法正确的是
A.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
B.制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于沸水中
C.欲配制质量分数为10%的CuSO4溶液,将l0 g CuSO4·5H2O溶解在90 g水中
D.除去铁粉中混有的少量铝粉.可加入过量的氢氧化钠溶液,完全反应后过滤
11、一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:
2X(g)+Y(g)![]() Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A.以X浓度变化表示的反应速率为0.001mol/(L·S)
B.将容器体积变为20L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0
12、在前一种分散系中慢慢滴加后一种试剂,能观察到先沉淀后变澄清的是
①氯化铝溶液中滴加氢氧化钠溶液
②偏铝酸钠溶液中加盐酸
③氢氧化钠溶液中滴加氯化铝溶液
④蛋白质溶液中滴入硫酸铜溶液
⑤氯化铝溶液中滴加氨水
⑥硝酸银溶液中滴加氨水
⑦氢氧化铁胶体滴加硫酸
A. ①②④⑥ B. ①②⑥⑦ C. ②③⑤⑦ D. ③④⑤⑥
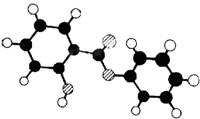 25、(本题14分)
25、(本题14分)
萨罗(Salol)是一种消毒剂,它的分子式C13H10O3,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键):
(1)根据右图模型写出萨罗的结构简式:________________________。
(2)萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸)。请写出萨罗在NaOH溶液中水解的化学方程式:
______________________________________________________。
(3)请设计一个方案,说明苯酚、碳酸、水杨酸的酸性依次增强(用化学方程式表示)。
_______________________________________________________
_______________________________________________________
______________________________________________________。
(4)同时符合下列四个要求的水杨酸的同分异构体共有_____种。
①含有苯环
②能发生银镜反应,不能发生水解反应;
③在稀NaOH溶液中,1mol该同分异构体能与2molNaOH发生反应;
④只能生成两种一氯代产物。
(5)现有水杨酸和苯酚的混合物,它们的物质的是之和为n mol。该混合物完全燃烧消耗a L O2,并生成b g H2O和 c L CO2气体体积均为标准状况下的体积)。
①分别写出水杨酸和苯酚完全燃烧的化学方程式(此处有机物可用分子式表示)。
_______________________________________________________;
_______________________________________________________。
②设混合物中水杨酸的物质的量为x mol,列出x=____________。(用含a、b、c的代数式表达)
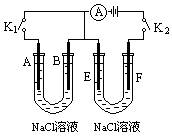 26、(本题13分)
26、(本题13分)
如下图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。
(1)打开K2,合并K1。
B为 极,A的电极反应为 ,最终可观察到的现象是 ,涉及的化学反应方程式有:
。
(2)打开K1,合并K2。
E为___________极,F极的电极反应为___________________,检验F极产生气体的方法是_______________________________。
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是______________________________,原因是___________________________________________________。
27、(本题14分)
A、B、D、E、F、G为短周期元素,且原子序数依次递增。A、F同主族,E、G同主族。A与其它非金属元素化合时易形成共价键,F与其它非金属元素化合时易形成离子键,且F+离子与E2-离子核外电子排布相同。由以上元素组成的物质BE和D2具有相同的电子数。请回答以下问题:
(1)F位于___________周期,_______________族;
(2)G的离子结构示意图_____________________;
(3)用电子式表示D2的形成过程_________________________;
(4)由A、E、F三种元素形成的化合物的化学式为____________,含有的化学键有_________________________(填写完整化学键类型),属于______________________晶体;
(5)B的最高价是____________,由A、B组成的化合物中,含A量最高的物质的化学式是_______________,含B量最高的气态物质的化学式是_______________;与D2式量相等的物质的化学式是____________________,含有的化学键有______________________________(填写完整化学键类型),属于________________晶体,有____________对共用电子对。
28、(本题19分)
某校化学小组同学设计以下装置,进行不同的实验。其中a为用于鼓入空气的气囊, b为铜丝螺旋,c为喷有少量碱液的棉花,d中盛有冰水。
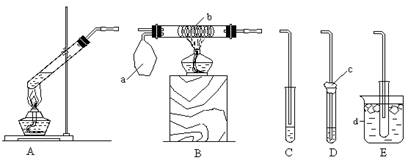
(1)若选用A装置做乙醛与新制氢氧化铜反应的性质实验,需去掉的仪器是____________。制备新制氢氧化铜的正确操作是在试管里加入10%的_______________(填写化学式)溶液2 mL,滴入2%的_____________(填写化学式)溶液4~6滴,振荡。乙醛与新制氢氧化铜反应的化学方程式为
_______________________________________________________。
(2)若用A装置做乙醇与乙酸酯化反应的实验,则还需连接的仪器是(填序号)___________________,该仪器中应加入的试剂是________________________。要加快酯化反应的速率,采用的措施是____________________。写出含18O的乙醇与乙酸反应的化学方程式____________________________________________。
(3)该小组同学欲做浓硫酸与铜反应的实验,并检验产生的二氧化硫。他们应选用的装置是_______________,用于检验产物二氧化硫可选用的试剂是_________________________,在所选装置中____________(填序号)部分是为了减少二氧化硫对空气的污染。
(4)该小组同学欲做乙醇氧化成乙醛的实验,他们可选用的装置是_________________。用制得的乙醛溶液再进行银镜反应,正确的操作顺序是(按先后顺序填写序号)______________________。
①向试管中滴入3滴乙醛溶液
②一边振荡一边滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止
③振荡后放入热水中,水浴加热
④在洁净的试管里加入1 mL 2%的AgNO3溶液
写出该银镜反应的化学方程式:
______________________________________________________。
(5)该小组同学欲用A装置做铜与浓硝酸反应的实验,请你判断该实验是否可行______________(填“是”或“否”),其原因是_______________________________________________________。
参考答案及评分标准
5、B 6、A 7、D 8、C 9、C 10、D 11、A 12、B
(每题6分,共48分)
25.(共14分)
(1)![]() (1分)
(1分)
(2)![]() +3NaOH→
+3NaOH→![]() +
+![]() +2H2O(2分)
+2H2O(2分)
(3)
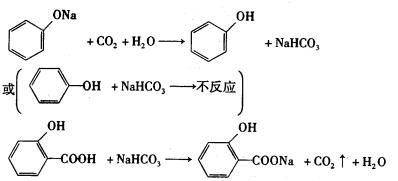 (4分)
(4分)
(4)2(2分)
(5)解:①C7H6O3+7O2=7CO2+3H2O ;C6H6O+7O2=6CO2+3H2O (2分)
②7x+6(n-x)= x=-6n(或x=-或x=-)(3分)
26.(共13分,除标定分数的外,其余每空1分)
(1)负 O2 + 2H2O + 4e- = 4OH- 溶液中有红褐色沉淀生成
2Fe+ O2 +2H2O =2Fe(OH)2 4Fe(OH)2 + O2 +2H2O= 4Fe(OH)3
(2)阴 2Cl- - 2e- = Cl2↑ 用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气(2分)
(3)AE (2分)
因为 A极产生OH-;E极中H+反应了,促进了水的电离,溶液中有OH-剩余。所OH-遇酚酞变红 (2分)
27.(共14分,每空1分,见错0分)
(1)3 ⅠA
(2)![]()
(3)![]()
(4)NaOH 离子键和极性共价键 离子晶体 ()
(5)+4 CH4 C2H2 、C6H6 C2H4 极性键和非极性键
分子晶体 6
28.(共19分,除标定分数的外,其余每空1分)
(1)带导管的单孔塞 NaOH CuSO4
CH3CHO + 2Cu(OH)2![]() CH3COOH + Cu2O + 2H2O
CH3COOH + Cu2O + 2H2O
(2)C 饱和碳酸钠溶液 加热和加入浓硫酸做催化剂
CH3COOH + C2H518OH![]() CH3CO18OC2H5 + H2O(2分,不标18O不给分,缺少条件扣1分)
CH3CO18OC2H5 + H2O(2分,不标18O不给分,缺少条件扣1分)
(3)AD 品红(答案合理即可) c
(4)ABE ④②①③ (2分)
CH3CHO +2Ag(NH3)2OH![]() CH3COONH4 +2Ag ↓+3NH3 +H2O
CH3COONH4 +2Ag ↓+3NH3 +H2O
(5)否 因为浓硝酸受热分解,且浓硝酸与铜在常温下反应已经很快(2分)