高三年级化学模拟训练题
命题、审核:常国福
可能用到的相对原子质量:H: 1、C :12、N: 14、O :16、Si;28
第Ⅰ卷(选择题,共48分)
一、选择题(每题3分,共48分,每小题只有一个选项正确)
 1、右图是同学们经常使用的某品牌修正液包装标签。小明仔细
1、右图是同学们经常使用的某品牌修正液包装标签。小明仔细
阅读后,结合自己的生活经验和所学知识得出了该修正
液的某些性质,小明的推测中不合理的是( )
A.修正液是一种胶体,均一、透明
B.修正液中含有的化学物质有毒
C.修正液的成分对纸张不具有腐蚀性
D.修正液的溶剂易挥发、易燃
2.下列叙述中正确的是( )
A.葡萄糖在人体内氧化分解是放热反应
B.酸碱中和反应是吸热反应
C.木柴燃烧需要用火柴点燃,所以木柴燃烧是吸热反应
D.苛性钠溶于水是放热反应
3、碘化砹(AtI)可发生下列反应:①2AtI+2Mg=MgI2+MgAt2 ②AtI+2NH3(l)=NH4I+AtNH2.对上述两个反应的有关说法正确的是( )
A.这两个反应都是氧化还原反应 B.②中AtI既是氧化剂,又是还原剂
C.反应①中的MgAt2既是氧化产物,又是还原产物 D.MgAt2的还原性弱于MgI2的还原性
4、设NA表示阿伏加德罗常数的数值,下列说法正确的是
A.由2H和18O所组成的水11g,其中所含的中子数为5NA
B.2.4g金属镁变为镁离子时失去的电子数为0.1NA
C.常温常压下,48gO2和O3混合气含有的氧原子数为3NA
D.SiO2晶体中,1mol硅原子与氧原子共形成2NA个Si-O键
5、下列各组离子在水溶液中能够大量共存,无论向溶液中加入哪种物质,只要使由水电离产生的c(OH—)=1×10—14mo1·L—1,溶液中都会有沉淀生成。该组离子可能是
A.NH4+、K+、Cl—、SO32— B.K+、Na+、SiO32—、AlO2—
C.Ba2+、Na+、HSO3—、NO3— D.Fe2+、NH4+、NO3—、C1—
6.将x、y、z、w四块金属分别用导线两两相连浸入稀硫酸中组成原电池。x、y相连时,x为负极;z、w相连时,电流由w→z;z、x相连时,z极上产生大量气泡;w、y相连时,w极发生氧化反应。据此判断四种金属的活动顺序是
A.x>z>w>y B.z>x>y>w C.x>y>z>w D.y>w>z>x
7.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
8.用两个质量都等于10.2克铜棒作电池插入硝酸银溶液中,接通直流电源,当阴极通入0.1摩电子时,溶液中还有大量的银离子,这时,阴阳两极的质量比为
A.21:10.2 B.10.2:21 C.3:1 D.1:3
9、下列反应的离子方程式正确的是
A.Fe3O4与稀硝酸反应:Fe3O4+8H+![]() Fe2++2Fe3++4H2O
Fe2++2Fe3++4H2O
B.电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3—+2OH—![]() CaCO3↓+CO32—+2H2O
CaCO3↓+CO32—+2H2O
D.Na2S溶液呈碱性:S2—+2H2O![]() H2S+2OH—
H2S+2OH—
10.某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO、NaCI中的一种或几种组成,将该粉末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温同压下测定)若将原混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体质量大于原混合粉末的质量,下列判断正确的是
A.粉末中一定有Na2O、Na2O2、NaHCO3
B.粉末中一定不含有Na2CO3和NaCI
C.粉末中一定不含有Na2O和NaCI
D.无法肯定粉末里是否含有Na2O2和NaCI
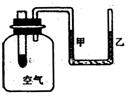 11.右图为某学生设计的一个实验装置,大试管中装有过氧化钠固体。现往大试管中加入水,下列说法中正确的是( )
11.右图为某学生设计的一个实验装置,大试管中装有过氧化钠固体。现往大试管中加入水,下列说法中正确的是( )
A.试管中发生了置换反应
B.一段时间后,看到“U”形管中的液面右边升高,左边下降
C.“贮存”在反应物中的总能量低于生成物的总能量
D.广口瓶中气体的分子在反应后增加
12、2005年10月12日我国成功发射了第二艘载人航天飞船——“神州六号”,实现了双人多天太空旅行。这标志着中国人的太空时代又前进了一大步。发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = – 534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol
B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol
C.N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l);△H = – 1135.7kJ/mol
D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol
13、右表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是
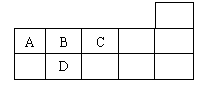 A.原子半径大小比较为A>B>C>D
A.原子半径大小比较为A>B>C>D
B.生成的氢化物分子间均可形成氢键
C.A与C形成的阴离子可能有AC32-、A2C42-
D.A、B、C、D的单质常温下均不导电
14、钡在氧气中燃烧时的得到一种钡的氧化物晶体,其结构如下图所示,有关说法正确的是
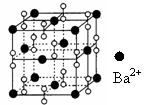 A.该晶体属于离子晶体
B.晶体的化学式为Ba2O2
A.该晶体属于离子晶体
B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与CsCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有12个
15.以下离子检验的结论可靠的是( )
A.往溶液中加入过量的氯水再加淀粉,不出现蓝色,说明有I-
B.往溶液中加入氯水,再加CCl4,CCl4层呈红棕色,说明有Br-
C.往溶液中加入盐酸,产生的气体能使澄清石灰水变浑浊,说明有CO32-
D.往溶液中加入BaCl2溶液和稀HNO3,有白色沉淀生成,说明有SO42-
16、现有下列四个图像:
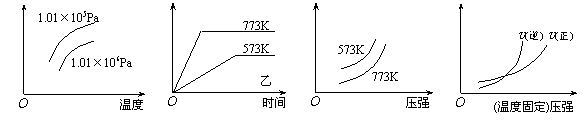 |
下列反应中全部符合上述图像的反应是
A.N2(g)+3H2(g) ![]() 2NH3(g);△H=-Q1kJ/mol(Q1>0)
2NH3(g);△H=-Q1kJ/mol(Q1>0)
B.2SO3(g) ![]() 2SO2(g)+O2(g);△H=+Q2
kJ/mol(Q2>0)
2SO2(g)+O2(g);△H=+Q2
kJ/mol(Q2>0)
C.4NH3(g)+5O2(g) ![]() 4NO+6H2O(g);△H=-808.7 kJ/mol
4NO+6H2O(g);△H=-808.7 kJ/mol
D.C(s)+H2O(g) ![]() H2(g) + CO(g);△H=-Q3kJ/mol(Q1>0)
H2(g) + CO(g);△H=-Q3kJ/mol(Q1>0)
选择题答题卡:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共52分)
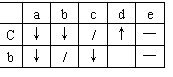 17(12分)、Ⅰ、已知a、b、c、d、e分别是Ca(OH)2、Ca(HCO3)2、HCl、Ba(NO3)2、Na2CO3五种物质水溶液的各一种。它们互相反应的情况如下表所示:“↓”表示生成沉淀;“↑”表示产生气体;“—”表示无明显现象;“/”表示实验未做。则
17(12分)、Ⅰ、已知a、b、c、d、e分别是Ca(OH)2、Ca(HCO3)2、HCl、Ba(NO3)2、Na2CO3五种物质水溶液的各一种。它们互相反应的情况如下表所示:“↓”表示生成沉淀;“↑”表示产生气体;“—”表示无明显现象;“/”表示实验未做。则
C是___ ___,e是______ __(均填化学式)
⑵某研究性学习小组拟用明矾制取Al2(SO4)3晶体和K2SO4晶体。
①实验室除明矾外,已备好的用品有蒸馏水、氨水、pH试纸,还缺少的试剂有 。
②制得Al2(SO4)3与K2SO4物质的量之比小于 。
Ⅱ.为探究CO2和NaOH确实发生了化学反应,某实验小组的同学设计了下列4种实验装置,请回答下列问题:

(1)选择实验装置(3),简述出现的实验现象以及产生该实验现象的原因:_________________ _______________________________________________________ 。
⑵某同学质疑上述所有实验设计,该同学质疑的依据是_______________________________
_________________________________________________________________________________________________________________________________________________________。
⑶在原实验的基础(4)上,请你设计实验证明CO2和NaOH肯定发生了化学反应。
18. Ⅰ(6分)科学实验和人类的生活经验告诉我们,化学反应中的物质变化和能量变化是紧密地联系在一起的。请回答以下问题:
(1)离子反应H+(aq) + OH-(aq) === H2O(1); △H = -57.3kJ·mol-1表示在稀溶液中,强酸和强碱反应生成1molH2O(1),这时的反应热叫做中和热。
①在中和热的测定实验中,下列溶液组合最合适的是______。
A.25mL0.4mol·L-1盐酸溶液与25mL0.4mol·L-1氨水
B.25mL0.4mol·L-1盐酸溶液与25mL0.41mol·L-1NaOH溶液
C.25mL0.4mol·L-1H2SO4溶液与25mL0.8mol·L-1NaOH溶液
D.25mL0.4mol·L-1H2SO4溶液与25mL0.41mol·L-1NaOH溶液
②举一例符合上述离子反应的非酸碱的中和反应化学方程式:__________________________
(2)已知CH4(g) + 2O2(g) === CO2(g) + 2H2O(l); △j=-890.31kJ·mol-1.
①当1molCH4(g)与2molO2(g)的总能量之和是3048.44kJ·mol-1,则1molCO2(g)与2molH2O(l)总能量之和是__________ kJ·mol-1
②某家庭用天然气(主成分是甲烷)为燃料,烧一壶开水,共需热量17.8kJ,现实际消耗4.48L 天然气,则热能的利用率约为______[均按标准状况的CH4计算,热能利用率=(实际利用的热量/供给的总热)×100%].
Ⅱ(5分)(1)室温下,0.01mol/L的硫酸氢钠溶液的pH为 ,在其中滴入等体积的pH=12的Ba(OH)2溶液后,所发生反应的离子方程式为 。
(2)室温下取0.2mol·L-1HCl溶液与0.2mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合溶液中水电离出的c(H+)__________0.2mol·L-1 HCl溶液中水电离出的c(H+)(填“>”、“<”、或“=”)。
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-) — c(M+) = ____________ mol·L-1 c(H+) - c(MOH) = _____________ mol·L-1
 19. (16分)Ⅰ(9分)根据下列反应框图填空。已知B、D、E、L常温下为密度比空气大的气体,D、E为单质,其它为化合物。A是一种淡黄色固体,C在水中的溶解度随温度的升高而减小,F、G均能与L的水溶液反应放出B。
19. (16分)Ⅰ(9分)根据下列反应框图填空。已知B、D、E、L常温下为密度比空气大的气体,D、E为单质,其它为化合物。A是一种淡黄色固体,C在水中的溶解度随温度的升高而减小,F、G均能与L的水溶液反应放出B。
(1)F的俗名是_______,工业上利用反应③生产______ 。
(2)反应①—⑤中,属于氧化还原反应的是_________ _。
(3)反应④的离子方程式为____________________、
(4)有一种单质能与H反应生成E,该反应的化学方程式为________。
(5)某气体M具有漂白性,既有氧化性,又有还原性,请写出同时有B、H和M生成的化学方程式___________________________。
ⅡA、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、 Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。
现做如下实验:
① A和E 的溶液显碱性,0.1mol/L A溶液的pH小于13;
②在B 的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C 的溶液中加入铁粉,溶液的质量增加;
④在D 的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
(1) 根据以上事实推断A-E的化学式:
A 、B 、C 、D 、E
(2)写出②和③的离子方程式:
②
③
21.Ⅰ(5分)根据下面的反应路线及所给信息填空。
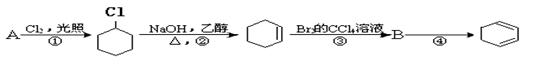

(一氯环已烷)
(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 ,③的反应类型是 。
![]() (3)反应④的化学方程式是 .
(3)反应④的化学方程式是 .
Ⅱ( 8分 )目前世界上有一种动向,即用天然气的主要成分,在催化剂和强热条件下
与水作用,制取一种混合气体(成分与水煤气相同),然后用来合成多种有机物。以
下是一种合成路线的流程图。D是钠盐;E是每两个D脱去一分子氢的生成物;G是
一种能使血红蛋白中毒的气体。

回答下列问题:
⑴ 写出下列物质的分子式:天然气(主要成份): ;混合气体: 。
结构简式:C: ;D: 。
⑵写也A→B反应的化学方程式: ,
反应类型:
写出A与F按物质的量之比为2︰1完全反应的化学方程式:
,反应类型:
化学参考答案
选择题答题卡:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | A | A | C | C | C | A | B | C | B | D | B | D | C | AD | B | B |
17. Ⅰ(1)c:Ca(HCO3)2 e:Ba(NO3)2
(2)硫酸溶液、氢氧化钾溶液、1:4(每空2分)
Ⅱ(1)气球变大;CO2与NaOH反应,使试管内压强减小.
(2)上述四种装置只能说明CO2减少(也可能是CO2溶解于水所致),并不能说明CO2一定和NaOH反应.
(3)取上述实验后的液体,滴加CaCl2溶液,若出现白色沉淀,说明原实验中生成了CO32-,即CO2和NaOH混合后产生的新物质,发生了化学反应.
18 Ⅰ(1)2(1分),Ba2++2OH—+2H++SO42— BaSO4+2H2O(2分)
(2) ① > ② 9.9×10-7 1.0×10-8(每空2分)
Ⅱ(1)B(2分)NaOH+NaHSO4==Na2SO4+H2O(2分)
(2)2.158.13(2分)10%(2分)
19、Ⅰ (1)纯碱、漂白粉 (2) ①③⑤
(3)Ca2+ + 2CLO- +CO2 + H2O =CaCO3 +2HCLO
(4) 2F2 + 2H2O ===4HF + O2
(5) C + 2H2SO4(浓)===CO2 ↑ + SO2 ↑+2H2O
Ⅱ.A、Na2CO3 B、AgNO3 C、Fe2(SO4)3 D、AlCl3 E、Ba(OH)2 (各2分)
Ag+ + NH3.H2O= Ag(NH3)2++2H2O ; Fe+2Fe3+= 3Fe2+ (每空3分)
20.Ⅰ(1) ![]()
![]() 环已烷 (2) 取代反应 加成反应 (3)
环已烷 (2) 取代反应 加成反应 (3)

![]()
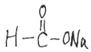
![]() Ⅱ(10分)
Ⅱ(10分)
⑴ (4分)CH4、CO、H2; 、
⑵ (6分)![]() 、氧化反应
、氧化反应
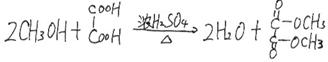
、取代反应(或酯化反应)