高三理科综合第三次月考化学部分卷
相对原子质量:H. 1 O. 16 Fe. 56 Cu. 56
第I卷
6、城市大面积绿化既能美化城市,又能净化城市,还能控制温室效应,其控制温室
效应的化学依据是( )
A,某些绿色植物可以吸收SO2
B,植物根系发达可以防止水土流失
C,绿色植物可以吸收转化CO2气体,降低空气中CO2浓度
D,森林覆盖可以防起风,阻挡流沙作用
7、NA为阿伏加德罗常数,下列叙述正确的为( )
A,标准状况下,22. 4LN2含共用电子对数为。
B,常温常压下,1molH2含共价键个数为NA。
C,常温常压下,18.0g重水(D2O)所含的电子数为10NA。
D,1molCH3CH2CH(CH3)2所含甲基个数为2NA。
8、下列反应过程中,同时有离子键、极性键和非极性键的断裂和形成的反应是( )
A,NH4![]() NH3 + HCl
B,NH3 + CO2 + H2O = NH4HCO3
NH3 + HCl
B,NH3 + CO2 + H2O = NH4HCO3
C,2NaOH+ Cl2 == NaCl + NaClO + H2O D,2Na2O2 + 2CO2 ==2Na2CO3 + O2
9、V L浓度为0. 5mol / L的盐酸,欲使其浓度增大一倍,可采取的措施为( )
A,通入标准状况下HCl气体11.2L
B,加入10mol/L的盐酸0.1VL,稀释到1.5 VL
C,将溶液加热浓缩到0.5VL
D,加入VL1.5mol /L的盐酸混合均匀
10、下列实验操作中,先后顺序正确的为( )
A,稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水
B,为测定硫酸铜晶体的结晶水的含量,称样时,先取一定量的晶体,后放入坩埚中
C、为检验酸性溶液中的Cl—和SO42-,先加入硝酸银溶液,滤去沉淀后加入硝酸钡溶液
D,在实验室制取干燥纯净的氯气时,先使氯气通过水(或饱和食盐水),后通过浓硫酸。
11、由IIIA族元素和VIA族元素B组成的阴离子如下图所示的结构,从其结构分
析,该阴离子所带的电荷数为( )
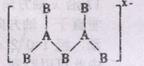
A,1 B,2 C, D,4
12、下列离子方程式书写正确的为( )
A,二氧化硅溶于烧碱溶液:SiO2 + 2OH— ==SiO32— + H2O
B,硫酸亚铁溶于稀硝酸:3Fe2+ +NO3— + 4H+ ==3Fe3+ + NO + H2O
C,亚硫酸钠溶液与双氧水混合:SO32— + 2H2O2 == SO42— + 2H2O + O2
D,亚硫酸铵溶液与氢氧化钡溶液混合:
SO32— + 2NH4 + + Ba2+ + 2OH— ==BaSO3 + 2NH3·H2O
13、NH3与O2混合气体100ml通过红热的铂丝网,充分反应后的混合气体再通过足
量的水最终收集到10ml的残留气体,则原混合气体O2的体积不可能为(气体
体积在相同条件下测定) ( )
A,12. 5ml B,21. 5ml C,64. 2ml D,70ml
第II卷
26、(16分)下图所涉及的物质均为中学化学的常见物质,其中C为O2,D为Cl2,
E为Fe单质,其余为化合物,
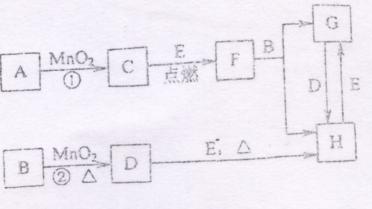
它们存在如图中的转化关系,反应中生成的水及次要的产物均已经略去。
(1) 写出有关产物的名称或化学式:
B ,E ,F .
(2)指出MnO2在相关反应中的作用:反应①中是 剂,反应②中是
剂。
(3)若反应①在加热的条件下进行,则A是 ,若反应①在常温条件下
的条件下进行,则A是 。
(4)写出B与MnO2在共热的条件下获得D的化学方程式:
27、(12分)下图甲是课本中实验验证铜和浓硝酸反应的装置,乙和丙是师生对演示实验改进后的装置。
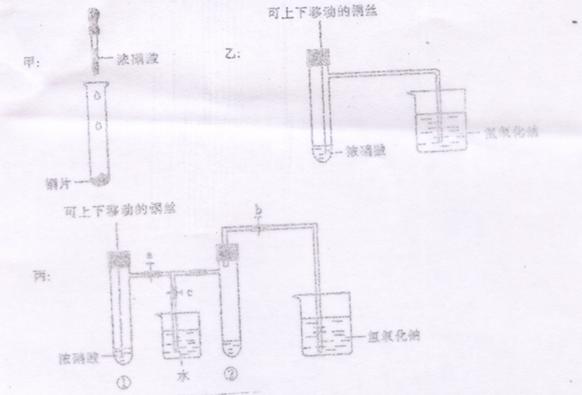
(1)甲 乙 丙三个装置中共同发生的化学方程式:
(2)和甲装置对比,乙装置的优点是:① ②
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。实验时先关闭活塞
,在打开活塞 ,才能使NO2气体充满②试管;当气体充满②
试管后,将铜丝提起与溶液脱离。欲使烧杯中的水进入②试管,应如何操作?
28、(12分)将等物质的量的A B C D四种物质混合后,充入一容器为VL的密闭容器,此时容器内的压强为P,然后在一定条件下发生如下反应:
a A(?)
+ b B(?) ![]()
![]() c C(g)
+ d D(?)
c C(g)
+ d D(?)
当反应进行一段时间后,测得A减少了n / v mol / L,B减少了n /2v mol/L,C增加了1.5n mol,D增加n mol,此时达到了化学平衡。
(1) 该化学方程式中,各物质的化学计量系数为
a ,b ,c ,d ,
(2)若只改变压强,反应速率发生变化,但化学平衡不发生移动。则在上述平衡混合物中加入物质,上述平衡 。
A,向正反应方向移动 B,向逆反应方向移动
C,平衡不移动 D,缺少条件,无法判断。
(4)若只升高温度,反应一段时间后,测得四种物质的物质的量又相等,则逆反应是 反应。(填“吸热”或“放热” )
29、(20分)Cu——Fe合金由于长时间放在空气中表面产生了一层氧化膜(成分为
Fe2O3和CuO),现进行如下实验(以下气体均在标况下测定)
①将此合金5.76g放在烧杯中,然后将稀硫酸逐渐加入至过量,收集到产生的气体为672ml,过滤得绿色溶液,还有滤渣B。
②将滤渣B投入到一定浓度的硝酸中,完全溶解,得NO. NO2混合气体896ml,
经测定该混合气体的密度为1.52g / L。
③将①中所得滤液加入同浓度的足量的稀硝酸,用排水法收集一烧瓶气体,在烧瓶中通入224ml氧气,气体完全溶解于水。
(1)过滤时用到的玻璃仪器为 。
(2)A中阳离子有 (填离子符号),B单质的化学式
(3)①中产生绿色溶液A的离子方程式为:
(4)原合金中Fe的物质的量为 ,Cu的物质的量为 。
化学部分答案
| 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| C | B | D | B | D | D | C | B |
26、(16分)(1)浓盐酸 Fe3O4 FeCl3
(2) 催化剂 氧化剂
(3)KClO3 H2O2
(4)MnO2 + 4HCl![]() MnCl2 + Cl2 + 2H2O
MnCl2 + Cl2 + 2H2O
27、(16分)(1)Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
(2)①可以控制反应
②可吸收NO2气体,防止污染环境
(3)c;a、b;
先关闭b,再关闭a,然后打开c,用手捂住试管②(合理答案均给分)
28、(12分)(1)2 1 3 2
(2)D
(3)吸热
29、(20分)(1)玻璃棒 烧杯 漏斗
(2)H+ , Fe2+; Cu
(3)Fe + 2H+ ==Fe2+ + H2 ;Fe + 2Fe3+ == 3 Fe2+ ;Fe + Cu2+ == Fe2+ +Cu
(4)0.04mol 0.05mol