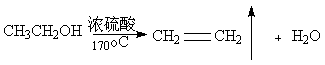高三理综化学部分模拟试卷
可能用到的相对原子质量:
C-12 H- 1 O-16 Na-23 Al-27 Cu-64 Cl-35.5
6.下列说法正确的是( )
A 铅笔芯的主要成分是金属铅
B 含磷洗衣粉的大量使用会造成水体富营养化
C CO气体有毒,在生有炉火的居室中多放几盆水,可吸收CO
D 绿色食品是指使用过化肥和农药生产出来的农副产品
|
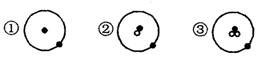
![]() 其中·表示质子或电子, 表示中子,则下列有关①②③的叙述正确的是 (
)
其中·表示质子或电子, 表示中子,则下列有关①②③的叙述正确的是 (
)
A.①②③互为同素异形体 B.①②③具有相同的质量数
C.①②③互为同位素 D.①②③是三种化学性质不同的粒子
8.镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有 ( )
A.Mg2+ B.Cu2+ C.Al3+ D.AlO2-
9.下列说法或表示方法正确的是( )
A.在稀溶液中,H+(aq)+ OH-(aq)= H2O(l);△H = -57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ
B. 由C(石墨)= C(金刚石);△H = +1.90 kJ·mol-1可知,金刚石比石墨稳定
C. 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
D. 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+ O2(g)= 2H2O(l);△H = -285.8 kJ·mol-1
10.氢氧化铁胶体稳定存在的主要原因是
A.胶粒带正电荷 B.胶粒作布朗运动
C.胶粒直径小于1nm D.胶粒不能通过半透膜
11.下列实验方案合理的是 ( )
A.用湿润的pH试纸测定某盐溶液的pH
B.用稀硫酸清洗长期存放氯化铁溶液的试剂瓶内壁所附着的不溶物
 C.用加热法分离I2和NH4Cl的混合物
C.用加热法分离I2和NH4Cl的混合物
D.为了更快得到氢气,可以用钝锌代替粗锌与稀硫酸反应
12.下列各组离子在溶液中可以大量共存,加入氨水后也不产生沉淀的是:( )
A.Na+、Ba2+、Cl-、SO42- B.H+、NH4+、Al3+、SO42-
C.K+、AlO2-、NO3-、OH- D.H+、Cl-、CH3COO-、NO3-
13.同温同压下,某容器充满O2时,质量为116g,充满CO2时质量为122g,现充满某气体,质量为114 g,则该气体可能为 ( )
A.H2S B.N2O C.Cl2 D. C2H4
26.(18分)下表是元素周期表的一部分,表中用字母列出了11种元素,请回答:
| a | b | ||||||||||||||||
| c | d | e | |||||||||||||||
| f | g | h | i | ||||||||||||||
| j | k | ||||||||||||||||
(1)上述所列元素的原子中,最外电子层只有两个电子的有(填元素符号) ;
(2)所列元素形成的单质中,有一种通常情况下为液态,该单质的化学式 ; d的氢化物的沸点比i的氢化物 (填“高”或“低”),主要原因是 。
(3)水解反应是一类重要的化学反应,中学已经学习许多的水解反应,请用所列11种元素组成能发生水解反应的物质来回答问题:
①写出一种由三种元素组成的无机物的化学式
②写出两种由三种元素组成且所属类别不同的有机物结构简式
(4)将等物质的量的f、h的单质投入足量水中,向反应后的溶液中逐滴加入浓度为1 mol/L的盐酸溶液,至100mL时沉淀刚好达到最大值,则投入h的物质的量为
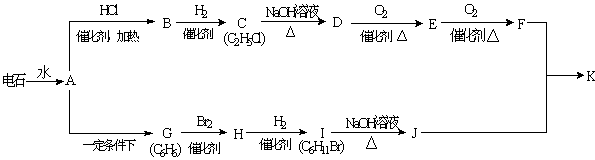
27.(10分) 已知A-K是中学化学中常见有机物,其中G不能使酸性高锰酸钾溶液褪色,他们之间有如下关系。
 |
试回答下列问题:
(1)写出实验室制取A的化学方程式: ................ ;
(2)写出C→D的化学方程式: ;
(3)写出D→E的化学方程式: ;
(4)B在一定条件下可合成一种重要的塑料,写出该合成反应的方程式:
;
(5)写出酯K的结构简式: ;
|
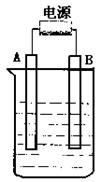
(1)B电极发生反应的电极反应式 。
(2)写出电解时反应的离子方程式 。
(3)电解后溶液的pH为 ;若要使电解后溶液恢复到
电解前的状态,则需加入 其质量为 g
(假设电解前后溶液的体积不变)
(4)请设计实验确定原溶液中可能所含的酸根离子,要求:
提出两种可能的假设,分别写出论证这两种假设的操作步骤、实验现象和结论。
假设一:
假设二:
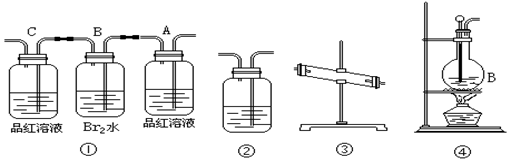 29.(16分)在实验室里制取乙烯时,常因温度过高而发生副反应,部分乙醇跟浓H2SO4反应生成SO2,CO2,水蒸气和炭黑。
29.(16分)在实验室里制取乙烯时,常因温度过高而发生副反应,部分乙醇跟浓H2SO4反应生成SO2,CO2,水蒸气和炭黑。
(1)用编号为①→④ 的实验装置设计一个实验,以验证上述反应混合气体中含CO2,SO2和水蒸气。已知装置 ③中加的固体药品是无水硫酸铜,则所用装置的连接顺序为(按产物气流从左到右的流向):
(2)实验的装置①中A瓶的现象是_____ ;结论为______ _ 。
B瓶中发生的化学反应除了溴单质与SO2 反应外最可能发生反应的化学方程式 。
若瓶C中品红溶液不褪色,可得到结论为_____ 。
(3)装置②中盛的溶液是_____ __以验证混合气体中有____ ____。
(4)装置④中发生反应的化学方程式为:___ 。
高三年级1月模拟考试理综(化学)试卷参考答案
6、B 7、C 8、D 9、A 10、A 11、B 12、C 13、D
26.(第1、4题各3分,其余每空2分,共18分)
(1)Mg、He、Fe (2)Br2;高;d的氢化物分子间存在氢键
(3) ①如Na2CO3、Al(NO3)3等盐,②如溴乙烷这类溴代烃,乙酸乙酯这类只含C、H、O的酯,麦芽糖、淀粉等二糖和多糖。
(4)0.1mol
27、(每空2分,共10分)(1)CaC2 +2H2O →Ca(OH)2 + C2H2 ↑
![]() (2)CH3CH2Cl+H2O
NaOH CH3CH2OH
+ HCl
(2)CH3CH2Cl+H2O
NaOH CH3CH2OH
+ HCl
(3)2CH3CH2OH + O2
![]() 2CH3CHO +2H2O
2CH3CHO +2H2O
![]() (4)nCH2=CHCl 催化剂 [ CH2——CH ] n
(4)nCH2=CHCl 催化剂 [ CH2——CH ] n
![]() (5)CH3COO
(5)CH3COO
28.(1-3每空2分,4每空3分,共16分)
(1)4OH--4e-=2H2O+O2↑
(2)2Cu2++2H2O 电解2Cu+O2↑+4H+
(3)1;CuO,2g (4)①假设原溶液中的酸根离子是SO![]() 。用试管取电解后的溶液少许,向其中加入酸化的BaCl2溶液,若有白色沉淀生成,则原溶液中所含的酸根离子是SO42-;②假设原溶液中的酸根离子是NO3-。用试管取电解后的溶液少许,向其中加入铜,微热,若铜溶解,并有无色气体生成,且在空气中变为红棕色,则原溶液中所含的阴离子是NO3-。
。用试管取电解后的溶液少许,向其中加入酸化的BaCl2溶液,若有白色沉淀生成,则原溶液中所含的酸根离子是SO42-;②假设原溶液中的酸根离子是NO3-。用试管取电解后的溶液少许,向其中加入铜,微热,若铜溶解,并有无色气体生成,且在空气中变为红棕色,则原溶液中所含的阴离子是NO3-。
29、(每空2分,共16分)
(1)④③①②
![]() (2)品红溶液褪色;证明有SO2气体;CH2=CH2 + Br2 BrCH2CH2Br
(2)品红溶液褪色;证明有SO2气体;CH2=CH2 + Br2 BrCH2CH2Br
证明SO2已经完全除尽;
(3)澄清石灰水;CO2气体
(4)