高三第一学期期中考试化学试题
(满分120分,考试用时100分钟)
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Si—28
S—32 Cl—35.5 K—39 Ar—40 Fe—56
第Ⅰ卷(选择题共48分)
一、 选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1. 很多化学物质名称中含有“水”,“水”通常有三种含义:①表示水这种物质;②表示水溶液;③表示物质处于液态。下列物质名称中的“水”不属于以上三种含义的是()
 A. 水晶B. 水银C. 溴水D. 重水
A. 水晶B. 水银C. 溴水D. 重水
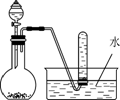
2. 右图是制取和收集某气体的实验装置,该装置可用于()
A. 浓盐酸和二氧化锰反应制取Cl2
B. 浓氨水和生石灰反应制取NH3
C. 浓硝酸与铜反应制取NO2
D. 过氧化钠固体和水反应制取O2
3. 学习化学时会遇到一些与“相等”有关的规律,下列有关“相等”的说法中正确的是()
A. 溶液稀释前后,溶质的质量一定相等
B. 中和反应中参加反应的酸和碱的质量一定相等
C. 微粒中的质子总数和电子总数一定相等
D. 物质发生化学变化前后,分子的总数一定相等
4. 同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2,进行喷泉实验。经充分反应后,瓶内溶液的物质的量浓度为()
A. ①>② B. ①<② C. ①=② D. 不能确定
5. 无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为()
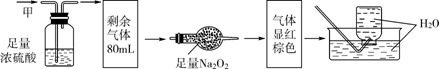
A. NH3、NO2、N2 B. NH3、NO、CO2
C. NH3、NO2、CO2 D. NO、CO2、N2
6. 对下列各种溶液中所含离子的判断合理的是()
A. 向无色溶液中加氯水变橙色,溶液中可能含:SO42-,Br-,OH-,Ba2+
B. 在c(H+)=10-14mol/L的溶液中可能含:Na+,AlO2-,CO32-,SO32-
C. 某溶液,加铝粉有氢气放出,则溶液中可能含:K+,Na+,H+,NO3-
D. 使紫色石蕊试液变红色的溶液中可能含:K+,Na+,Ca2+,HCO3-
7. 俄罗斯杜布纳核研究所和美国劳伦斯利弗莫尔实验室的科学家在2004年2月的美国《物理评论C》杂志上发表文章宣布,他们新合成了元素周期表上的第115号和第113号元素。科学家在利用回旋加速器进行的实验中,用具有20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果4次成功制成4个第115号元素的原子。这4个原子在生成数微秒后衰变成第113号元素。前者的一种核素为289115X。下列有关叙述正确的是()
A. 115号元素衰变成113号元素是化学变化
B. 核素289115X的中子数与质子数之差为174
C. 113号元素最高正价应为+3
D. 115号与113号元素的原子质量比为115∶113
![]()
![]() 8. 2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为①2MoS2+7O2高温2MoO3+4SO2;②MoO3+2NH3·H2O=(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl;④H2MoO4高温MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是()
8. 2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为①2MoS2+7O2高温2MoO3+4SO2;②MoO3+2NH3·H2O=(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl;④H2MoO4高温MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是()
A. MoS2煅烧产生的尾气可直接排放
B. MoO3是金属氧化物,也是碱性氧化物
C. H2MoO4是一种强酸
D. 利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
二、 选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意)
9. 下列反应的离子方程式错误的是()
A. 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B. 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3·H2O+H2O
C. 氢氧化铝与足量盐酸反应:Al(OH)3+3H+=Al3++3H2O
D. 过量CO2通入氢氧化钠溶液中:CO2+2OH-=CO32-+H2O
10. 阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是()
A. 标准状况下,1.12L的SO3所含的原子数约为0.2×6.02×1023
B. 标准状况下,2.24L一氧化氮与氮气混合气所含分子数约为0.1×6.02×1023
C. 1mol CH3+(碳正离子)中含电子数目约为10×6.02×1023
D. 1mol D2O含有的中子数约为8×6.02×1023
11. 下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是()
| (Ⅰ) | (Ⅱ) | |
| A | 少量SO2通入Ba(OH)2溶液 | 过量SO2通入少量Ba(OH)2溶液 |
| B | 少量浓氨水滴入Al2(SO4)3溶液 | 少量Al2(SO4)3溶液滴入浓氨水 |
| C | 0.1mol Cl2通入含0.2mol FeBr2的溶液 | 0.3mol Cl2通入0.2mol FeBr2溶液中 |
| D | 过量BaCl2溶液与少量Na2SO4溶液相混合 | 少量Ba(NO3)2溶液与过量MgSO4溶液相混合 |
12. 有五个系列同族元素的物质,101.3kPa时测定它们的沸点(℃)如下表所示:
| ① | He -268.8 | (a) -249.5 | Ar -185.8 | Kr 151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (b)58.7 | I2 184.0 |
| ③ | (c)19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| ④ | H2O 100.0 | H2S -60.0 | (d)-42.0 | H2Te -1.8 |
| ⑤ | CH4 -161.0 | SiH4 -112.0 | GeH4 -90.0 | (e) -52.0 |
对应表中内容,下列叙述中正确的是()
A. a、b、c的化学式分别为Ne、Br2、HF
 B. 系列②物质均有氧化性;系列③物质对应水溶液均是强酸
B. 系列②物质均有氧化性;系列③物质对应水溶液均是强酸
C. 系列④中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
D. 上表内物质HF和H2O,由于氢键的影响,其分子特别稳定
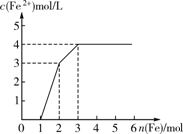
13. 现有含有Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液,且Fe与稀硝 酸反应的还原产物仅为NO。若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间关系如右图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为()
A. 1∶1∶1 B. 1∶3∶1 C. 3∶3∶8 D. 1∶1∶4
14. 将2.4g Fe、Mg合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体VL(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6g。则收集到的气体体积V的值不可能为()
A. 6.72 B. 1.12 C. 1.00 D. 0.986
第Ⅱ卷(非选择题共72分)
三、 (本题包括1小题,共6分)
15. (6分)据报道,在全国各地发生了多起因洁污剂混合放出氯气而中毒的事件,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。请根据你的化学知识作出如下推断(这一推断的正确性有待证明):
(1)当事人使用的液态洁污剂之一必定含氯元素,若可能存在的离子组合是ClO-和Cl-或者ClO3-和Cl-,则当另一种具有_____________(填“酸性”、“碱性”或“中性”)的液态洁污剂与之混合,可能发生反应而产生氯气。
(2)写出ClO-和Cl-可能发生的反应的离子方程式__________________________________。
(3)若反应转移了0.5mol的电子,则ClO3-和Cl-可能发生的反应产生的氯气在标准状况下体积为________________。
四、 (本题包括2小题,共18分)
16. (8分)现有下列短周期元素性质的数据:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
试回答下列问题:
(1)上述元素中处于第VA族的有____________,处于第二周期的有_________(以上均用编号表示)。
(2)上述元素中金属性最强的是____________(用编号表示),写出其原子的电子排布式_____________。
(3)写出元素①、⑧形成的化合物与KOH溶液反应的化学方程式______________________。
(4)写出元素⑦形成单质的电子式_____________,画出元素②形成的简单离子的结构示意图:________________。
(5)写出由上述元素形成的10电子微粒的微粒符号____________________。
17. (10分)某研究性学习小组进行了“实验室制Si”的研究,他们以课本为基础,查阅资料得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si ②Mg在点燃的条件下即可与SiO2反应
③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4 ④Si和SiO2均不与稀H2SO4反应
⑤SiH4在空气中自燃
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(1)该小组“实验室制Si”的化学方程式是____________________________。
(2)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是______________________
___________________________________________________________________________________________________________________________________________________________________________。
五、 (本题包括1小题,共12分)
18. (12分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
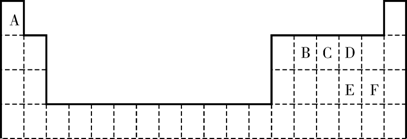
(1)B和E的最高价氧化物对应的水化物中酸性较强的是________________。(填化学式)
写出可以验证该结论的一个离子反应方程式______________________________________。
(2)王水可溶解不能与硝酸反应的金属如Au、Pt等,其原因是王水中不仅含有HNO3,还有反应生成的Cl2和NOCl。假设NOCl中所有原子都达到了8电子稳定结构,试写出NOCl的电子式_______________________。
(3)EBC-和A2D2反应生成了ED42-和可参加大气循环的两种无毒无害气体,试写出该反应的离子方程式:____________________________________________。
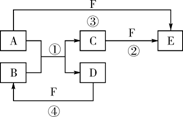 六、 (本题包括1小题,共12分)
六、 (本题包括1小题,共12分)
19. (12分)A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应。
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,
A、F所含元素同周期,则反应①的化学方程式是_______________________________________。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是_____________________________________________。
(3)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则A、D反应产物的电子式是_________________,
反应③的化学方程式是__________________________________________。
(4)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,B的结构式是__________________,反应④的化学方程式是___________________________________。
七、 (本题包括1小题,共12分)
20. (12分)白色粉末A是NaHCO3与KHCO3的混合物,取甲、乙、丙3份质量不同的A样品分别与50.0mL相同浓度的盐酸充分反应,得到气体的体积(标准状况)与A的质量关系如下表:
| 实验组别 | 甲 | 乙 | 丙 |
| 稀盐酸的体积(mL) | 50.0 | 50.0 | 50.0 |
| A样品的质量(g) | 2.84 | 5.25 | 7.00 |
| 气体的体积(L) | 0.672 | 0.896 | 0.896 |
试计算:
(1)该盐酸的物质的量浓度。
(2)混合物中NaHCO3的质量分数。
八、 (本题包括1小题,共12分)
21. (12分)由A、D、E、G四种元素组成的化合物的分子式为AxDy(E2G4)z。
已知:(1)x、y、z为整数,且x+y+z=7。
(2)取8.74g该化合物溶于水,加入酸和强氧化剂,化合物中的E、G元素完全转化成气态化合物EG2 2.688L(标准状况下),其密度为1.965g/L,EG2能使澄清石灰水变浑浊。
(3)发生上述反应后,A、D以阳离子存在于溶液中,往溶液里加入过量的铁粉,其中使D离子全部还原所消耗的铁粉质量为0.56g。
(4)化合物中D元素的百分含量为12.8%。
试通过计算和推理确定E、G、D、A各是什么元素,求出x、y、z的值,并写出该化合物的分子式(注意:请按指定位置进行计算和推理)。
解:(1)确定E和G:E是_______;G是_____________。
(2)确定x、y、z和D:x=_________,y=__________,z=__________;D是_______________。
(3)确定A并写出化合物的分子式:A是__________;该化合物的分子式是______________。
推理过程:
参考答案
1. A2. D3. A4. C5. B6. B7. C8. D9. D10. B11. BD12. AC
13. D14. A
15. (6分,每空2分)
(1)酸性(2)ClO-+Cl-+2H2=Cl2↑+H2O (3)6.72L
16. (8分,每空1分)(1)④⑦ ①③⑦
(2)⑥ 1s22s22p63s1
(3)Al2O3+2KOH=2KAlO2+H2O
(4)∶NN∶ ![]()
(5)Na+、Mg2+、Al3+、O2-、N3-
17. (10分)(1)Mg+SiO2=2MgO+Si(4分)
(2)Mg2Si+2H2SO4=2MgSO4+SiH4↑ Mg+Si=△ Mg2Si SiH4+2O2=SiO2+2H2O(6分)
18. (12分,每空3分)
(1)H2SO4 2H++CO32-=H2O+CO2↑(HCO3-)
(2)O∶∶N∶Cl∶
(3)2SCN-+11H2O2=2SO42-+2CO2↑+N2↑+10H2O+2H+
19. (12分,每空2分)(1)2C+SiO2=高温Si+2CO↑
(2)2Fe2++Cl2=2Fe3++2Cl-
H
∶ ∶
(3)〔 H∶N∶H〕+ 〔∶Cl∶〕- 4NH3+5O2 Pt=△ 4NO+6H2O
∶ ∶
H
(4)O=C=O C+4HNO3(浓)=△ CO2↑+4NO2↑+2H2O
20. (12分,每小问6分)HCO3-+H+=H2O+CO2↑
(1)CHCl=(0.896/22.4)/0.05=0.8mol/L
(2)设混合物中有NaHCO3 xmol,
KHCO3 ymol,根据题意有:
84x+100y=2.84
x+y=0.03 得:
x=0.01mol
y=0.02mol
WNaHCO3%=0.84/2.84×100%=29.6%
21. (12分,除标注外,每空1分)(1)C O
(2)3 1 3 Fe
(3)K K3Fe(C2O4)3
推理过程:(略)(4分)