高三化学第二次月考试卷(化学)
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分100分。考试时间100分钟。
可能用到的相对原子质量:H-1 C-12 O-16 Mg-24 S-32 Fe-56 Cu-64 Na 23 Cl 35.5
第I卷(选择题 共48分)
(本题包括16小题,每小题3分,共48分。每题只有一个选项符合题意)
1.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
A. B.
B.
C D.
D.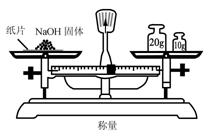
2.在电解水制取H2和O2时,为了增强导电性常常要加入一些电解质,下列物质不宜选用的是( )
A.NaOH B.H2SO4 C.NaCl D.Na2SO4
3.吸进人体内的O2,有2%转化为氧化性极强的活性氧副产物,如 O 等,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用含硒化合物Na2SeO3清除人体内的活性氧,在消除活性氧时,Na2SeO3的作用是
A.还原剂 B.氧化剂 C.既是氧化剂又是还原剂 D.以上均不是
4.有X、Y、Z、M四种金属,已知:X可以从Y的盐溶液中置换出Y;X和Z作原电池电极时,Z为正极;Y和Z的离子共存于电解液中,Y离子先放电;M的离子氧化性强于Y的离子,则这四种金属的活动性由强到弱的顺序是( )
A.X>Y>Z>M B. X>Z>M>Y C. M>Z>X>Y D. X>Z>Y>M
5.下列反应的离子方程式书写正确的是( )
A. 次氯酸钙溶液中通入过量的二氧化碳
Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
B.硫酸亚铁溶液中加过氧化氢溶液 Fe2++2H2O2+4H+=Fe3++4H2O
C.用氨水吸收少量二氧化硫 NH3·H2O+SO2=NH4++HSO3-
D.硝酸铁溶液中加过量氨水 Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
6.下列叙述正确的是
A.少量金属钠保存在乙醇中
B.用稀硫酸清洗做过银镜反应实验的试管
C.仅用水就能鉴别酒精、苯、CCl4
D.用盐析的方法可除去淀粉溶液中混有的少量NaCl
7.设NA表示阿伏加德罗常数的数值,下列说法正确的是
A.由2H和18O所组成的水11g,其中所含的中子数为5NA
B.2.4g金属镁变为镁离子时失去的电子数为0.1NA
C.常温常压下,48gO2和O3混合气含有的氧原子数为3NA
D.在标准状况下,2.24L苯中含有0.6mol碳原子
8.高一新教材中的一个演示实验:用脱脂棉包住0.2gNa2O2粉末,放在石棉网上,在脱脂棉上滴加几滴水;可以观察到脱脂棉剧烈燃烧起来。由实验现象所得出的结论正确的是
A.Na2O2与H2O反应是一个放热反应
B.Na2O2与H2O反应中有氢气生成
C.Na2O2与H2O反应中有氢氧化钠生成
D.Na2O2与H2O反应中有中间产物H2O2生成
9.氰气的化学式为(CN)2,它的性质和卤素相似,称为拟卤素,对其性质和有关化合物性质的叙述不正确的是
A. NaCN 和AgCN都易溶于水
B.HCl和HCN都易形成白雾
C.MnO2可与HCN反应生成(CN)2
D.(CN)2和NaOH溶液反应生成NaCN、NaCNO 和H2O
10. 将标准状况下,将VL A气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为ρg/cm3,则此溶液的物质的量浓度(mol/L)为
A.![]() B.
B.![]()
C.![]() D.100VρM/(MV+2240)
D.100VρM/(MV+2240)
11.RO![]() +2Rx+6H+===3R+3H2O是某同学作业中的一个离子方程式,其中Rx所带电荷模糊不清,若R所带的电荷用x表示,则x应是
+2Rx+6H+===3R+3H2O是某同学作业中的一个离子方程式,其中Rx所带电荷模糊不清,若R所带的电荷用x表示,则x应是
A.“+” B.“2-” C.“3+” D.“4-”
12.氢气是人类最理想的能源。已知在25℃、101kPa下,1 g氢气完全燃烧生成液态水时放出热量142.8 kJ,则下列热化学方程式书写正确的是
A.2H2 + O2
2H2O;△H = – 142.9 kJ/mol
B.2H2(g) + O2(g)
2H2O(l);△H = – 142.9 kJ/mol
C.2H2(g) + O2(g)
2H2O(l);△H = – 571.6 kJ/mol
D.2H2(g) + O2(g)
2H2O(l);△H = + 571.6 kJ/mol
13.已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是
A.上述实验证明氧化性:MnO4—>Cl2>Fe3+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
14.下列物质性质递变规律正确的是
A.酸性HFO4>HClO4>HBrO4>HIO4 B.稳定性HF>HCl>HBr>HI
C.酸性:HF>HCl>HBr>HI D.还原性:I—>Br—>Cl—>S2—
15.将过量的CO2分别通入:①CaCl2溶液 ②Na2SiO3溶液 ③Ca(ClO)2溶液 ④饱和Na2CO3溶液 ⑤NaAlO2溶液。最终有沉淀生成的是 ( )
A、②④⑤ B、②③⑤ C、②⑤ D、①②③④⑤
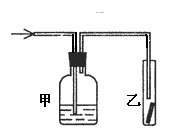 16.将潮湿的Cl2通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是
16.将潮湿的Cl2通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是
①浓硫酸 ②NaOH溶液 ③KI溶液 ④饱和食盐水
A.①② B.②③
C.①②③ D.①②③④
第II卷(非选择题 共52分)
17.(12分)A~J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作杀菌消毒剂。
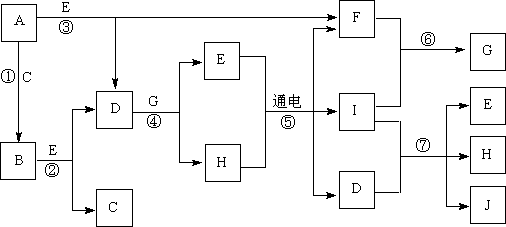
(1)写出反应⑤的化学方程式:_________________________________。
(2)写出反应⑦的离子方程式:_________________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式:____________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则阳极的电极反应式为:__________________。________极(填“阴”或“阳”)附近溶液由无色变为红色。
18.(6分)在淀粉KI溶液中滴入少量NaClO溶液,并加入少量硫酸,溶液立即变为蓝色,其反应的离子方程式为: 。
在上述蓝色溶液中滴入足量的Na2SO3溶液,蓝色立即消失,其反应的离子方程式为:
。
从以上事实可知,ClO-、I2、SO42—的氧化性由强到弱的顺序是 。
19.(4分)一个体重50 kg的健康人含铁元素2 g。这2 g铁以Fe2+和Fe3+的形式存在。Fe2+易被吸收,给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用Vc可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
(1)人体中经常进行Fe2+与Fe3+的转化,可表示为:![]() 在过程A中,Fe2+作_________剂;过程B中,Fe3+被_________。
在过程A中,Fe2+作_________剂;过程B中,Fe3+被_________。
(2)“服用Vc可使食物中的Fe3+转化为Fe2+”这句话指出,Vc在这一反应中作_________,具有_________性。
20.(6分) 有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
试根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是_________,一定不含的物质是_________________,可能含有的物质是_________________。(以上各种物质均写化学式)
(2)写出②步变化的离子方程式。
21.(12分)我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:

已知:沉淀池中发生反应的化学方程式为CO2+NH3+NaCl+H2O NaHCO3↓+NH4Cl
(1)写出煅烧炉中发生反应的化学方程式
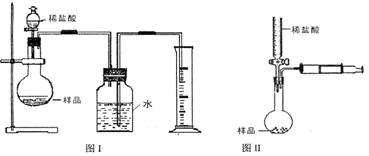
(2)该实验得到的纯碱中含有氯化钠。甲同学设计的测定样品纯碱含量的方法如图Ⅰ,试回答:
|
①写出烧瓶中发生反应的离子方程式
②该设计方案会造成误差,其原因可能为(写两种即可)
、
③若读取量筒中水的体积时俯视,由此会造成实验结果 (填偏高、偏低或不影响)。
(3)乙同学设计的测定样品中纯碱含量的方法如图Ⅱ,试回答:
①检查该装置气密性的方法为:
②设滴定管的起始读数为a mL,终了读数为b mL,注射器测定排出的气体为c mL(标准状况),称得样品质量为m g,则原样品中碳酸钠的质量分数表达式为 (用含a、b、c、m的代数式表示)。
22. (12分) Cl2通入70℃的NaOH水溶液中,发生氧化还原反应,反应完成后,测得溶液中NaClO和NaClO3的物质的量之比为4:1,则①配平溶液中所发生反应化学方程式
![]()
![]()
![]()
![]()
![]()
![]() Cl2 + NaOH
= NaCl + NaClO3+ NaClO + ______
Cl2 + NaOH
= NaCl + NaClO3+ NaClO + ______
②反应中的氧化剂是__________________,氧化产物_____________________;
③此反应的离子方程式为_____________________________________________
④已知生成0.1molNaClO,反应中转移的电子数是__________mol,若溶液的体积正好是100ml,则溶液中NaCl的物质的量浓度为_______________mol/L。
嵩明一中高三化学第二次月考
化学试题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|

17.(12分)
(1)
(2)
(3)
⑷ 、
18. 。
。
。
19、(4分)(1) , (2) ,
20、(6分) (1)原白色粉末中一定含有的物质是_________,一定
不含的物质是______________,可能含有的物质是_________________。(以上各种物质均写化学式)
(2)写出②步变化的离子方程式 。
21.(12分)(1)
(2)1
2 、
3
(3)①
②
22. ① Cl2 + NaOH = NaCl + NaClO3+ NaClO+ ______
②_______________________,_________________________;
③__________________________________________________________
________;
④_______________________mol,__________________mol/L。
参考答案
1.C 2.C 3.A 4.D 5.D 6.C 7.C 8.A 9.A 10.B 11.B 12.C 13.A 14.B 15.A 16.C
17.(12分)
(1)2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(2)Cl2+2OH-![]() Cl-+C1O-+H2O
Cl-+C1O-+H2O
(3)4AlCl3+6Na2O2+6H2O![]() 4Al(OH)3↓+12NaCl+3O2↑
4Al(OH)3↓+12NaCl+3O2↑
(4)2C1--2e-![]() Cl2↑ 阴
Cl2↑ 阴
18.2I—+ ClO—+ 2H+ = I2 + Cl—+ H2O(2分)
I2 + SO32—+ H2O = 2I— + SO42— + 2H+(2分)
ClO— > I2 > SO42—(2分)
19(4分)(1)还原 还原 (2)还原剂 还原
20. (6分)(1)Ba(NO3)2、Na2CO3 CuSO4 NaCl
(2)② BaCO3+2H+===Ba2++CO2↑+H2O
21.(12分)(1)2NaHCO3![]() Na2CO3+CO2↑+H2O
(2分)
Na2CO3+CO2↑+H2O
(2分)
(2)CO32-+2H+![]() CO2↑+H2O (2分)
CO2↑+H2O (2分)
②盐酸挥发出氯化氢气体;或CO2溶于水;或内外压强不等;或导管中的水未完全排出(答出任意两种即可)(2分)
③偏高(2分)
(3)①关闭酸式滴定管活塞,用手捂热烧瓶,若注射器活塞外移,松手后又回到原来位置,说明气密性良好。或关闭滴定管活塞,记下注射器活塞刻度,然后轻拉(推)活塞,松手后如果注射器活塞能回到原来位置,说明装置气密性良好。(2分)
②![]() 或
或 ![]()
![]() (2分)
(2分)
22. ① 7 Cl2 + 14 NaOH = 9 NaCl + 1 NaClO3+ 4 NaClO + _7H2O _____
②Cl2,NaClO和NaClO3;
③7Cl2+14OH-=9Cl-+ClO3-+4ClO-+7H2O;
④0.225 mol,2.25 mol/L。