高三年级化学第一学期三校联考
化 学 试 题
YCY
考试时间:100分钟 试卷总分:100分
可能用到的相对原子质量:
H一1 Li一7 C一12 N一14 O一16 Na一23 A1一27 P一31 S一32 Cl一35.5 K—39 Ca一40 Fe一56 Cu一64 Br一80
I卷(48分)
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.今年4月22日是第37个“世界地球日”,宣传主题是“善待地球——珍惜资源、持续发展”。 下列说法不符合这一主题的是 ( )
A.启动沿海风力发电,创建绿色能源之都
B.分类回收生活垃圾,合理利用变废为宝
C.大力发展生态农业,创建生态安全城市
D.化工企业集中选址,尽量减少污染区域
2.在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是( )
A.硫铁矿燃烧前要粉碎,因为大块的硫铁矿不能燃烧
B.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便SO3吸收完全
C.SO2氧化为SO3时需使用催化剂,因为炉气中SO2会与杂质反应
D.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
3.下列说法正确的是 ( )
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;
甲醇、乙二醇和丙三醇互为同系物
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HCl的相对分子质量大于HF,所以HCl的沸点高于HF
D.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有
共价键的离子型化合物
4.下列有关说法不符合事实的是 ( )
A.同温同压下,气体的体积取决于气体的物质的量的多少
B.氧化剂的氧化性强弱取决于该氧化剂中某元素化合价的高低
C.用焰色反应检验K+时须透过蓝色钴玻璃观察
D.元素的相对原子质量取决于该元素各核素的相对原子质量和在自然界中的原子百分比
5.为了从新制的氯水中制得高浓度的HClO,可向氯水中加入的试剂是 ( )
A.Na2CO3 B. H2SO4 C.CaCO3 D. Ca(OH)2
6.下列叙述正确的是 ( )
A.分子晶体中都存在共价键
B.F2、C12、Br2、I2的熔沸点逐渐升高与分子间作用力有关
C.含有极性键的化合物分子一定不含非极性键
D.只要是离子化合物,其熔点一定比共价化合物的熔点高
7.已知下列事实:①高氯酸的酸性比硫酸强。②盐酸是比氢硫酸更强的酸。③氯化氢比硫化氢稳定。④氯气与硫化氢混合可产生单质硫。⑤氯元素、硫元素最高化合价分别是+7、+6 价,其中能说明氯元素的非金属性比硫元素强的是 ( )
A.①②③ B.②④⑤ C.①③④ D.②③⑤
8.NA为阿伏加德罗常数,下述叙述中正确的是: ( )
A.标准状况下,11.2L四氯化碳所含分子数为0.5 NA
B.31g白磷含有1.5NA个共价键
C.7.1g C12与足量NaOH溶液反应转移的电子数为0.2NA
D.工业上铜的电解精炼时电解池中每转移1mol电子时阳极上溶解的铜原子数为0.5 NA
9.下列物质间发生化学反应:①H2S+O2,②Na+O2,③Cu+HNO3,④P2O5+H2O,⑤Fe+Cl2,⑥ Cu+S,⑦Na2CO3+HCl, ⑧S+O2, ⑨H2S+NaOH。在不同条件下得到不同产物的是
( )
A.全部都是 B.①③④⑤⑦⑧
C.①②③④⑦⑨ D.①②③④⑤⑧⑨
10.化学用语是学习化学的重要工具,下面用来表示物质变化的化学用语中,正确的是( )
A.氢气燃烧的热化学方程式: 2H2(g)+ O2(g)=2H2O(l); △H= +570kJ·mol-1
B.甲烷碱性燃料电池的负极反应: CH4+10OH--8e-= CO32-+7H2O
C.饱和FeCl3溶液滴入沸水中的反应: FeCl3+3H2O = Fe(OH)3↓+3HCl↑
D.次氯酸钙溶液中通入过量的SO2: ClO-+ H2O + SO2 =HSO3-+ HClO
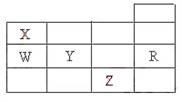
11.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,
|
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
12.某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为( )
A.11.2克 B.16.8克 C.19.6克 D.22.4克
13.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
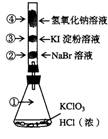 ( )
( )
| ① | ② | ③ | ④ | |
| A | 黄绿色 | 无色 | 紫色 | 白色 |
| B | 黄绿色 | 橙色 | 蓝色 | 白色 |
| C | 无色 | 橙色 | 紫色 | 白色 |
| D | 黄绿色 | 橙色 | 蓝色 | 无色 |
14. 等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,且VA=VB+VC,则在C的生成物中,该金属元素的化合价为
( )
A.+1 B. +2 C. +3 D. +4
15.在下列溶液中通入过量SO2的过程中,始终不出现沉淀的是 ( )
A.Ba(NO3)2溶液 B.BaCl2溶液 C.Ba(OH)2溶液 D.氢硫酸(H2S)
16.![]() K分别与
K分别与![]() Cl和
Cl和![]() Cl(氯的相对原子质量为35.5)构成的11.92 g氯化钾中,含
Cl(氯的相对原子质量为35.5)构成的11.92 g氯化钾中,含![]() Cl的质量是 ( )
Cl的质量是 ( )
A.1.42克 B.1.48克 C.1.50克 D.1.58克
II 卷(52分)
二、(本题包括三小题,共26分)
17.(7分)将SO2气体分别通入什么溶液中能出现下述现象?
①紫色变红色 __;②紫色褪去 ;③橙色变无色 ;
④蓝色变无色 ______;⑤红色变无色, 加热后又恢复红色 _____;⑥无色变浑浊后又澄清 ;⑦无色溶液产生淡黄色沉淀 _____。
18.(10分) 甲、乙、丙、戊都具有如图所示的结构或结构单元,图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同。已知:
甲、乙是同一类晶体中的各自结构单元,单质甲能与乙发生置换反应,丙、丁、戊三种粒子含有等量的电子数,其中丙、丁是同一类晶体中的分子或分子集团,常温下丁呈液态,能产生两种等电子数的粒子,戊是阳离子。
 (1)写出液态丁产生两种等电子粒子的电离方程式:
(1)写出液态丁产生两种等电子粒子的电离方程式:
(2)室温下含有戊的盐溶液,其pH 。
A.>7 B.=7
C.<7 D.以上都有可能
(3)丙是目前重要的能源
①丙和丁在催化、加热条件下得到可燃性的两种气体,其反应的化学方程式是
②现代高能电池中,常用丙作燃料电池的原料,在碱性介质(KOH溶液)的情况下,其正极反应的电极方程式为
(4)甲、乙高温反应时,甲被破坏了1 mol共价键,则参加反应的乙为 g。
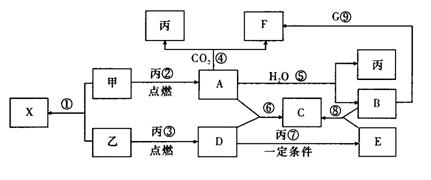
19.(9分)甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族,丙为无色气体。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同。G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图:
|
请回答:
(1)丙的名称为 ,C的化学式为 ,X的电子式为 。
(2)写出A与X 的溶液反应的化学反应方程式 。
(3)写出B与G溶液反应的离子方程式: 。
(4)在上图的反应中,不属于氧化还原反应的是(填序号) __________。
三、实验题(15分)
20.(4分)下列实验操作或对实验事实的描述不正确的是____________________(填序号,错选一个倒扣1分,不出现负分)
① 用量筒量得稀硫酸溶液8.0mL;② 浓硫酸不小心沾在皮肤上,应立即用大量的水冲洗;③用热的浓HCl洗涤附着有MnO2的试管;④在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 ;⑤ Fe(OH)3胶体与FeCl3溶液可用过滤的方法分离;⑥用碱式滴定管量得KMnO4溶液20.50mL ;⑦ 实验室快速制备少量H2、O2、NH3、HCl可以用同一种气体发生装置;⑧ 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
21.(11分)二氯化硫(SCl2)熔点-78℃,沸点59℃。密度1.638g/L。遇水易分解。二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应合成二氯化硫的实验装置。
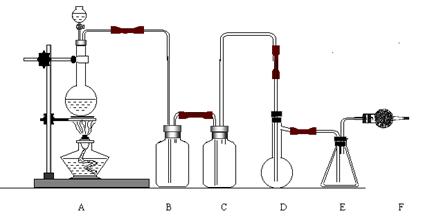
试回答下列问题:
①装置A中发生反应的化学方程式为: 。
②装置B盛放的药品是 C中是 。
③实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
④实验时,D装置需加热至50-59oC,最好采用何种方式加热 。如何防止E中液体挥发 。
⑤F装置中干燥管内所盛物质是 作用是: 。
⑥由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为: 。
四、计算题(11分)
22.(3分) 把a g 某主族R的最高价氧化物R2O 溶于b g水中,欲计算R的相对原子质量。
(1)还缺少的条件是_________________(限选一项)
A.溶液的体积V mL B.溶质的溶解度S/g(100g水)
C.溶质的质量分数w D.溶质的物质的量浓度c mol·L-1
(2)Ar(R)=___________________________(列出表达式)
23.(8分)白色粉末A由Na2S 、Na2SO3 、Na2S2O3、Na2SO4、 NaCl等物质中的三种混合而成,取一定量A样品投入100mL2.2mol·L-1盐酸中,充分反应后过滤,最终得到100mL,pH为0的溶液。将此溶液蒸干,只得到8.19g纯净物B。
(1)B的化学式为___________________.
(2)请通过计算推断A中是否有NaCl?
(3)若反应中还生成V L(标准状况)气体,且气体不会使品红溶液褪色,则取出的A样品中含有Na2S多少摩?(用含V的代数式表示)。
(4)A中各物质物质的量之比不同,所产生的沉淀的量也不同,上述A样品与盐酸反应可生成沉淀的质量最大值是多少克 ?
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | B | D | B | C | B | C | B | C | B | D | A | B | A | B | B |
17.(7分)答案:①石蕊试液。②KMnO4溶液。③溴水。④I2和淀粉的混合溶液。⑤品红溶液。⑥石灰水。⑦氢硫酸。
18.(10分)
(1) 2H2O![]() H3O++OH-(2分) (2) D(2分)
H3O++OH-(2分) (2) D(2分)
(3)①
CH4+H2O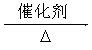 CO+3H2 (2分) ②2H2O+O2+4e-=4OH―(2分)
CO+3H2 (2分) ②2H2O+O2+4e-=4OH―(2分)
(4) 15(2分)
|
(2)Na2S+Na2O2+2H2O =
4NaOH+S (3)OH-+HCO![]() =CO
=CO![]() +H2O
+H2O
(4)⑧⑨
20.② ⑤ ⑥ ⑧(4分,选对一个得1分,错选一个倒扣1分,不出现负分)
21.(方程式各2分,其余各1分,共11分)
(1)MnO2 +4HCl(浓) ![]() MnO2 +Cl2↑+2H2O
MnO2 +Cl2↑+2H2O
(2)饱和食盐水(或水),浓硫酸
(3)增大反应接触面
(4)水浴加热,并用温度计控制温度;将锥形瓶放入冰水中冷却
(5)碱石灰(或固体氢氧化钠或生石灰);防止空气中水蒸气进入并吸收残留余的氯气。
(6)SCl2 +SO3 = SOCl2 +SO2
 |
22.(1)C(1分) (2) (2) (2分)
23.(1)NaCl (1分) (2)A中必含有NaCl (2分) (3)![]() 摩 (3分)
摩 (3分)
(4) 2.56 克 (2分)