高三年级化学第一学期期中考试
化 学 试 题
YCY
本卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试时间90分钟.
注意事项:
1.答第一卷前,考生务必将自己的姓名、考考试科目涂写在答题卡上,考试结束将试题卷和答题卡一并交回。
2.每小题选出答案后,用2B铅笔把答题卡上对应的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其分答案标号,不能答在试题卷上。
以下数据可供解题时参考
相对原子质量:H—1 O—16 Si—28 S—32 Mg—24 Al—27 Cu—64
第Ⅰ卷(选择题 共46分)
一、选择题(本题包括5个小题,每题只有一个选项合乎题意)
1.2005年9月16日(国际臭氧层日),我省签署了“加速淘汰消耗臭氧层物质行动,创建
国家臭氧层友好省倡议书”,向国际社会庄严承诺;提前1年完成我省淘汰CFCs(全氯
氟烃)两类消耗臭氧层的物质。 ( )
A.无氟冰箱是由于使用不含氟的制冷剂,因而是环保型的。
B.我国目前已投入批量生产的哈龙(灭火剂)替代品一七氟丙烷的化学式是C3HF7
C.汽车尾气、超音速飞机排出的废气及工业废气也可以破坏臭氧层
D.人类广泛脾于制致冷剂、喷雾剂、发泡剂、清洗剂的氟氯烃类化学物质是破坏臭氢层的主要原因。
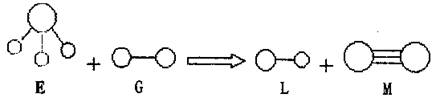
2.已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、
M分子的元素原子序数均小于10,如下图,则下列判断错误的是 ( )
|
A.G是最活泼的非金属单质 B.L是极性分子
C.E能使紫色石蕊试液变蓝色 D.M化学性质活泼
3.下列说法中正确的是 ( )
A.能自发进行的反应都是放热反应 B.凡是熵增加的反应一定能自发进行
C.在一定条件下,吸热反应可自发进行 D.放热的熵增加的反应不一定能够自发进行
4.NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.1.0L1.0mol·L-1的FeCl3滴入沸水中,制得的Fe(OH)3胶体粒子数为NA
B.9gD2O中含有的电子数为5NA
C.22.4L的N2和CO的混合气体中所含的原子数为2NA
D.Na2O2与水反应生成1.12LO2(标准状况),反应中转移的电子数为0.1NA
5.在密闭容器中加少量水,常压下通氨气至饱和,则会建立下列平衡:
![]() NH3+H2O NH4++OH-。若要使该反应中的OH-浓度增大,应采取的措施是( )
NH3+H2O NH4++OH-。若要使该反应中的OH-浓度增大,应采取的措施是( )
A.水
B.加NH4Cl晶体
C.将氨气的压强增大1倍后,再通入密闭容器中
D.通HCl气体
二、选择题(本题包括12个小题,每题只有一个选项合乎题意)
6.化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学
键时释放(或吸收)出的能量。
|
现提供以下化学键的键能(kJ·mol-1)
P—P 198 P—O 360 O—O 498
则反应P4(白磷)+3O2→P4O6的反应热△H为 ( )
A.-1638kJ/mol B.+1638kJ/mol
C.-126kJ/mol D.+126kJ/mol
|
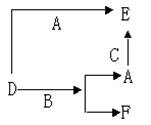
有如下所示的转化关系。下列说法中错误的是 ( )
A.D、E中一定都含有A元素
B.单质B肯定是氧化剂
C.A、B、C中一定有一种是O2
D.若A是非金属,则B一定为金属
8.单质Ti的机械强度高,抗蚀能力强,
有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取TiO2,再由
![]()
![]() TiO2制金属Ti。由TiO2制金属Ti的反应为
TiO2制金属Ti。由TiO2制金属Ti的反应为
①TiO2+2C+2Cl2 TiCl4+2CO ②TiCl4+2Mg 2MgCl2+Ti
则下列叙述正确的是 ( )
A.由反应①可知,Cl2是氧化剂,TiCl4是氧化产物
B.由反应①可知,可用CO在高温下把TiO2还原成Ti
C.由反应②可知,若有24gMg参加反应,就可生成1molTi
D.由反应②可知,金属Mg还原性比金属Ti的还原性强
9.A、B、C、D四种短周期元素,原子半径依次减小,A与C的核电荷数之比为3:4;D
可分别与A、B、C形成电子数相等的分子X、Y、Z。下列叙述正确的是 ( )
A.X、Y、Z的稳定性逐渐减弱
B.A、B、C、D只能形成4种单质
C.X、Y、Z三种化合和物的溶沸点逐渐升高。
D.A、B、C、D之间只能形成共价化合物
|
A.三种元素分别属于二、三周期
B.元素的原子半径大小关系是B>A>C
C.1molC与水反应时,转移的电子数为2mol
D.最高价氧化物对应的水化物具有氧化性和不稳定性的是B
11.有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的一种或几种。为确定其成分,做如下实验:①取部分溶液,加放适量Na2O2固体产生无色无味的气体并生成白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)溶液,有白色沉淀产生。下列推断正确的是( )
A.肯定有K+、HCO3-、MnO4- B.肯定有Al3+、Mg2+、、HCO3-
C.肯定有Al3+、Mg2+、SO42- D.肯定有Al3+、Mg2+、NH4+、Cl-
12.下列说法正确的是 ( )
A.pH=2和pH=1的硝酸中c(H+)之比为1:10
B.Na2CO3溶液c(Na+)与c(CO32-) 之比为2:1
C.0.2mol·L-1与0.1 mol·L-1醋酸中c(H+)之比为2:1
D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2) 之比为3:1
13.叠氮酸(NH3)与醋酸酸性相似,下列叙述中错误的是 ( )
A.HN3水溶液中微粒浓度大小顺序为:c(NH3)>c(H+)>c(N3)>c(OH-)
B.NH3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3)>c(OH-)>c(H+)
D.HN3与CO2含相等电子数
![]() 14.以水为溶剂进行中和滴定的原理是:H3O++OH-→2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(1)+SO2(1) SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是 ( )
14.以水为溶剂进行中和滴定的原理是:H3O++OH-→2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(1)+SO2(1) SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是 ( )
A.该滴定反应可以表示为:SO32-+SO2+→2SO2
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C.自离解的存在,说明SO2是离子化合物
D.可通过导电能力变化来判断是否到达滴定终点
15.下列离子组能大量共存的是 ( )
A.Ca2+、HCO3-、Cl-、Na+ B.Fe2+、NO3-、Cl-、OH-
C.Al3+、Cl-、S2-、Na+ D.ClO-、I-、H+、Na+
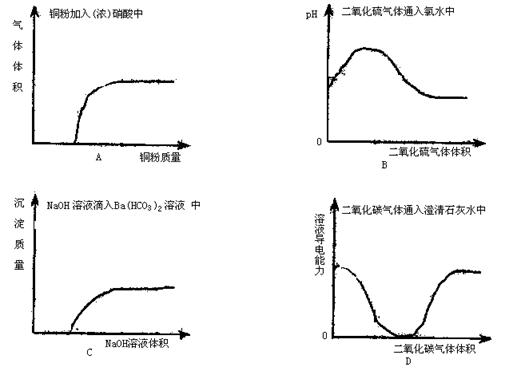
16.下列实验过程中,产生的现象与对应的图象相符合的是 ( )
|
17.有200mLMgCl2和AlCl3混合液,其中c(Mg2+)为0.2mol/L,c(Cl-)为1.3mol/L,欲将Mg2+、Al3+恰好转化为沉淀,需加4mol/LNaOH溶液 ( )
A.40mL B.65mL C.72mL D.128mL
第Ⅱ卷(非选择题 共6题,共54分)
三、(本题包括2小 共17分)
18.(8分)
虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功。直到1986年,化学家Karl Christe首次用学化方法制得了F2。他提出的三步反应如下(反应①、②里氟元素化合价不变):
①KMnO4+KF+H2O2+HF→K2MnF6+ +H2O
②SbCl5+HF→SbF5+
③2K2MnF6+4SbF5→4KSbF6+2MnF3+F2 ↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为 ,为什么填这一物质,试用氧化还原反应理论解释: 。
(2)完成反应②: 。
(3)反应③中的氧化剂为 ,被氧化的元素为 。
(4)配平反应①,并标出电子转移的方向和数目。(将答案写在下面空格上)
。
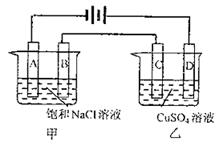
19.(9分)电解原理在化学工业上有着广泛的应用,按下图所示装置进行电解实验:
|
回答下列问题:
工作一段时间后,
(1)A极附近可观察到的现象是
。
检验B电极上反应产物的通常方法是
。
甲电池中电解反应的离子方程式是
; 溶液中还可能存在的离子反应方程式是
。
(2)甲槽溶液的pH ;乙槽溶液的pH (填“上升”、“下降”或“不变”)。当A极上收集到22400mL气体(标准状况)时,乙装置的C极上可得到
|
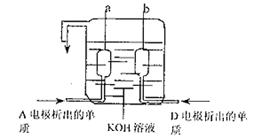
(3)A、D两极上析出的物质可以制成
已在阿波罗飞船中使用的新型电源,
其结构如右图所示,两个电极均由多
孔性碳构成,通入的两种单质由孔
隙逸出而在电极表面放电。a是电
源的 极,电极反应式为
。
四、(本题包括2小 题,共20分)
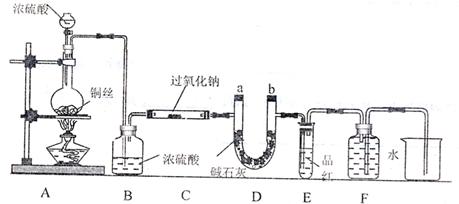
|
如图安装仪器,检查装置气密性后 填加药品并滴入适量浓硫酸。回答下列问题:
(1)点燃A处酒精灯,不久可观察到烧瓶中产生大量气体,写出反应的化学方程式:
;C处玻璃管管壁发热,管内药品的颜色变化是 。
(2)在反应过程中如何用较简便的操作证明反应产生了O2?
写出C管内反应的化学方程式,并标出电子转移的方向和数目:
。
(3)F处用排水法收集气体,从什么现象可证明收集的气体中已不含SO2?
。
(4)待反应结束后,取C玻璃管内的少量固体,装入试管中,加水溶解时未产生气体,则如何证明产物中有Na2SO3?
。
(5)待反应结束后,取C玻璃管内的少量固体,装入试管中,加入足量的盐酸,再加入氯化钡溶液,发现有白色沉淀生成,试分析产生沉淀的原因:
(6)有的同学认为:若将装置末端的烧杯换成量筒(或量气管),则可通过测定排水的体积来测定Na2O2药品的纯度。试判断该方案是否可行: (填“是”、“否”)原因是 。
21.(9分)已知常温下,AgBr的Ksp=4.9×10-13mol2·L-2、Agl的Ksp=8.3×10-17mol2·L-2。
(1)现向含有AgI的饱和溶液中:
①加入固体AgNO3,则[I-] (填“变大”、“变小”或“不变”,下同);
②若改加更多的AgI,则[Ag+] ;
③若改加AgBr固体,则[I-] ;而[Ag+] 。
(2)有关难溶盐的溶度积及溶解度(与AgBr、AgI无关),有以下叙述,其中正确的是
。
A.两种难熔盐电解质,其中KsP小的溶解度一定小
B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解又达到平衡时,AgCl的溶
度积不变,其溶解度也不变。
C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该
物质的溶度积。
D.溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉
淀。
E.难溶盐电解质的Ksp温度有关
F.同离子效应(加入与原电解质具有相同离子的物质),使难溶盐电解质的溶解度
变小,也使Ksp变小。
(3)现向含有NaBr、KI均为0.002mol/L的溶液中加入等体积的浓度为
4×10-3mol/LAgNO3溶液,则产生的沉淀是 (填化学式);若向其中再加入适量的NaI固体,则最终可发生沉淀转化的总反应式表示为:
。
五、(本题包括2小题,共17分)
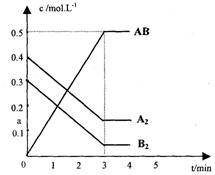
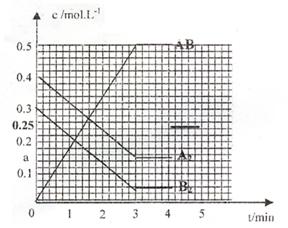
|
(1)该反应进行到 时达到平衡,
用AB表示的平均反应速率为:
(分数表示)。
(2)图中对应的a的数值是 ,
该反应的化学平衡常数Kc=
(保留分数)
温度升高Kc值 (填“增大”、
“减少”或“不变”)
(3)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在上图中画出4min~5min的AB浓度的变化线。
(4)在相同条件下,若开始时向此容器中国入的A2(g)、B2(g)和AB(g)的物质的量分别为amol、bmol、cmol,要使达平衡时各物质的体积分数不变,则a、b、c应满足的关系是 (用含a、b、c的代数式表示)。
23.(8分)某研究性学习小组进行了甲、乙、丙三组实验:各取30mL相同浓度的NaOH溶液,然后分别缓慢地加入组成相同的硅铝合金粉末(可加热反应),得到下表中有关数据。(假定反应前后溶液的体积不变化,气体体积均在标准状况下测定。已知:
Si+2NaOH+H2O=Na2SiO3+2H2yc↑
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/g | 0.275 | 0.605 | 0.715 |
| 气体体积/mL | 392 | 784 | 784 |
请回答下列问题:
(1)甲组实验中,NaOH溶液 (选填“过量”、“不足”、“适量”)。
(2)合金中硅铝的物质的量之比为 。
(3)计算氢氧化钠溶液的物质的量浓度(列出计算过程)
参考答案
第I卷(选择题,共46分)
一、(2分×5=10分)
1.A 2.D 3.C 4.D 5.C
二、(3分×12=36分)
6.A 7.B 8.D 9.C 10.D 11.C 12.A 13.B 14.C 15.A
16.D 17.B
第Ⅱ卷(非选择题,共54分)
三、(共17分)
18.(8分)
(1)O2(1分),KMnO4中Mn化合降低,则H2O2必作还原剂(1分)
(2)SbCl5+5HF→SbF5+5HCl(1分)
![]() (3)K2MnF6(1分),负一价的F(1分)
(3)K2MnF6(1分),负一价的F(1分)
(4)2KMnO4+2KF+3H2O2+10HF→2K2MnF6+3O2+8H2O
(3分,其中电子转移的数目与方向1分)
19.(9分)
![]() (1)溶液呈粉红色 用湿润的KI淀粉试纸靠近B电极,试纸变蓝色。
(1)溶液呈粉红色 用湿润的KI淀粉试纸靠近B电极,试纸变蓝色。
2CI-+2H2O Cl2↑+2OH-+H2↑ Cl2+2OH-=Cl-+ClO-+H2O
(2)上升 下降 64g Cu
(3)负极 2H2+4OH-=4H2O+4e- (每空1分)
四、(20分)
20.(11分)
(1)Cu+2H2SO4=CuSO4+SO2↑+2H2O 淡黄色变白
 (2)打开D装置b处橡皮塞,插入带火星的木条,如果木条复燃,说明产生了氧气。(没有打开装置不给分)
(2)打开D装置b处橡皮塞,插入带火星的木条,如果木条复燃,说明产生了氧气。(没有打开装置不给分)
2Na2O2 +2SO2====2N2SO3+O2
(3)E处的品红不褪色,说明氧气中不含有二氧化硫。
(4)向该溶液中加入稀盐酸,有气体产生。
(5)由于过氧化钠有氧化性,反应过程中有部分亚硫酸钠被氧化成硫酸钠,与加入的氯化钡反应产生难溶于酸的沉淀。
(6)否;因为可能存在部分SO2与Na2O2反应生成Na2SO4而无O2产生。——方程式2分,余空各1分
21.(9分)
(1)①变小 ②不变 ③变小 变大
(2)B、E
(3)Agl、AgBr (2分)
AgBr(s)+I-(aq)=AgI(s)+Br-(aq)
五、(17分)
22.(9分)
(1)3min 1/6mol·L-1·min-1
(2)0.15 100/3减少 ——以上每空1分
|
(4)![]() (2分)
(2分)
23.(8分)
(1)过量 (2分)
(2)1:1 (2分)
(3)分析表中数据可知:30mLNaOH溶液恰好能与0.55g合金反应生成784mLH2.
0.55g硅铝合金中Si与Al的物质的量均为0.01mol。
由方程式知:Si——2NaOH——2H2
Al——NaOH——![]() H2
H2
NaOH溶液物质的量浓度:
C(NaOH)=n(NaOH)/v(aq)=(0.01mol×2+0.01mol)/0.03L=1mol/L
(4分 其他解法正确同样得分)