高三年级化学第一学期期中联考试卷
化学学科
命题、审校:富阳中学 董 君
本卷说明:
1.有关相对原子质量:Ar(H)-1 Ar(O)-16 Ar(C)-12 Ar( S)-32 Ar(Na)-23
2.考试时间为90分钟,满分为100分。
一、选择题(每小题只有一个选项符合题意,24×2分=48分)
1.下列化学名词正确的是
A.坩锅 B.研钵 C.乙酸乙脂 D.石碳酸
2.下列过程中属于化学变化的是
①白色的硫酸铜粉末久置于空气中变成蓝色
②同素异形体之间的互变
③福尔马林用来浸制标本
④同分异构体之间的互变
⑤蜂蚁螫咬处涂稀氨水或小苏打溶液可以减轻痛苦
⑥氯化钠溶液通电后导电
A.只有①②④⑤ B.①②③④⑤⑥ C.只有③④⑤ D.只有①④⑤
3.之所以氢氧化铁胶体比较稳定,是因为氢氧化铁胶粒“撞而不沉”,而氢氧化铁胶粒撞而不沉的主要原因是
A.氢氧化铁胶粒直径小于1nm B.氢氧化铁胶粒直径大于100nm
C.氢氧化铁胶粒作不规则运动 D.氢氧化铁胶粒都带正电荷
4.下列关于分子间作用力的说法,正确的是
A.扩散现象表明分子间不存在引力
B.液体难于被压缩表明液体中分子间作用力总是引力
C.硫晶体熔化需要吸引能量,这与单质硫分子间的作用力无关
D.分子间既存在引力也存在斥力
5.据报道,重庆开县曾发生了天然气矿井“井喷”事件,喷出的气体其主要成分是甲烷、硫化氢(H2S)、氰化氢(HCN)等多种气体,造成290多人中毒死亡。你认为喷出的气体的主要成分是
A.一种纯净物
B.全部由无机化合物组成的混合物
C.全部由有机化合物组成的混合物
D.由无机化合物和有机化合物组成的混合物
6.下列各组物质的分类都正确的是(括号里的是类别)
A.空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质)
B.液氨(氢化物)、NH4Cl(铵盐)、HNO3(氧化性酸)、NaOH(强电解质)
C.HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃)
D.NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯)
7.下列物质不属于胶体分散系的是
A.有色玻璃
B.澄清石灰水
C.淀粉溶液
D.饱和FeCl3溶液滴入沸水中形成的混合物
8.有关化学用语正确的是
A.丁烯的最简式C4H8 ![]() B.丙醇的结构简式C3H8O
B.丙醇的结构简式C3H8O
C.四氯化碳的电子式![]() D.硬脂酸的分子式是C17H35COOH
D.硬脂酸的分子式是C17H35COOH
9.下列离子方程式书写正确的是
A.碳酸氢钙溶液中加入浓盐酸:CO32-+2H+=CO2↑+H2O
B.碳酸钠发生水解:CO32—+2H2O ![]() H2CO3+2OH—
H2CO3+2OH—
C.苯酚钠溶于醋酸溶液:C6H5O¯+CH3COOH=C6H5OH+CH3COO¯
D.碘化亚铁溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl¯
10.某无色溶液中加入铝片有氢气产生,则在该溶液中一定能大量共存的离子组是
A.Cl-、NO3-、Ba2+、Na+ B.SO42-、CH3COO-、Al3+、Mg2+
C.Na+、K+、SO42-、Cl- ![]() D.Na+、Ba2+、Cl-、HCO3-
D.Na+、Ba2+、Cl-、HCO3-
11.下列变化中,属于吸热反应的是
A. Zn片投入稀硫酸中 B. 点燃的镁条在二氧化碳中继续燃烧
C. 灼热的碳与二氧化碳反应 D. NO2 转化成N2O4
12.下列有关燃烧热和中和热的说法,正确的是
A.150kPa时,1molC完全燃烧,放出的热量为C的燃烧热
B.101kPa时,1molC燃烧生成CO时,放出的热量为C的燃烧热
C.101kPa时,2gH2燃烧生成水蒸气时,放出的热量为H2的燃烧热
D.含1molH2SO4的稀溶液和含1molNaOH的稀溶液反应,放出的热量就是H2SO4和NaOH反应的中和热
13.下列工业生产的说法错误的是
A.氯碱工业中隔离两电极的材料是阳离子交换膜,因此该生产方法又称“阳离子交换膜法”
B.生产普通玻璃的主要原料及设备:石灰石、石英、纯碱及玻璃熔炉
C.常压下SO2转化为SO3的转化率已经较高,所以SO2氧化时不需用高压条件
D.合成氨的反应是放热反应,因此工业合成氨时常采用低温条件
14.用石墨电极电解NaBr水溶液时,下列叙述正确的是
A.电解时在阳极得到Br2,在阴极得到金属Na
B.若在阳极附近的溶液中滴入淀粉溶液,溶液呈蓝色
C.若在阴极附近的溶液中滴入酚酞试液,溶液变红色
D.若取阳极附近的溶液少量于试管中,滴入少量CCl4,振荡静置后上层溶液呈棕色
15.某溶液的PH=a,向其中插入两惰性电极,通电一段时间后测知溶液的PH=b,且b=a,则该电解质是(设电解液的温度没有变化)
A.稀H2SO4 ![]() B.饱和CuSO4
B.饱和CuSO4
C.NaCl溶液 D.饱和Na2CO3溶液
16.已知在酸性溶液中,下列物质都能氧化KI,自身发生如下变化:Fe3+→Fe2+;MnO4—→Mn2+;Br2→Br—;HNO3→NO2。如果分别用等物质的量浓度、等体积的这些物质的水溶液氧化足量的KI,得到I2最多的是
A.Fe3+ B.MnO4— C.Br2 D.HNO3
17.下列各组物质的溶液相互反应,无论前者逐滴滴入后者,还是后者逐滴滴入前者,边滴边振荡,反应现象完全相同的是
A.AlCl3和NaOH ![]() B.
B.![]()
C.![]() D.Na2CO3和HNO3
D.Na2CO3和HNO3
18.已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子排布相同,则下列关系式正确的是
A.a=b+m+n B.a=b-m+n C.a=b+m-n D.a=b-m-n
19.某学生设计了如图的方法对A盐进行鉴定:
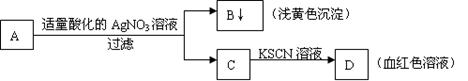 |
由此分析,下列结论中,正确的是
A.A一定为FeBr2溶液 B.A中一定有Fe3+
C.B为AgI沉淀 D.C中一定有Fe3+
20.下列有关次氯酸的说法正确的是
A.次氯酸分子的结构式为H-Cl-O
B.次氯酸的化学性质与盐酸完全相同
C.次氯酸中所有的原子都达到8电子稳定结构
D.次氯酸是共价化合物
21.有下列两组命题
| A组 | B组 |
| Ⅰ.H—I键键能大于H—Cl键键能 | ①HI比HCl稳定 |
| Ⅱ.H—I键键能小于H—C1键键能 | ②HCl比HI稳定 |
| Ⅲ.HI分子间作用力大于HCl分子间作用力 | ③HI比HCl稳定 |
| Ⅳ.HI分子间作用力大于HCl分子间作用力 | ④HI沸点比HCl低 |
B组中命题正确,且能用A组命题加以正确解释的是
A.Ⅰ ① B.Ⅱ ②
C.Ⅲ ③ D.Ⅳ ④
22.已知三角锥型分子G是由两种直线型分子E和F在一定条件下发生反应生成的,见下图,组成E、F、G分子的元素原子序数均小于8,则下列判断正确的是
E F G
A.镁条在E气体中不能燃烧 B.G气体遇到浓盐酸冒白雾
C.G气体遇到干燥的红色石蕊试纸变蓝 D.E是比较稳定的分子
23.在有乙离子存在的情况下,欲用丙试剂来检验溶液中是否含有甲离子,下表所加丙试剂能够对甲离子进行成功检验的是(在实验过程中不允许加热、过滤、萃取等操作)
| 选项 | 丙试剂 | 甲离子 | 乙离子 |
| A | 稀盐酸、Ba(NO3)2溶液 | SO42- | SO32- |
| B | AgNO3溶液 | Cl- | Br- |
| C | KSCN溶液 | Fe2+ | Fe3+ |
| D | 稀氨水 | Al3+ | Ag+ |
24.据美国《科学》杂志报道,意大利科学家合成了一种新型氧分子,它是由4个氧原子构成的O4分子,如果已知氧原子核外的电子并不都在同一个平面内运动,且分子中每个原子均达到稳定结构,则下列关于该分子的叙述正确的是
A.O4是O3的同位素
B.O4分子象白磷分子一样为正四面体构型
C.O4分子中的原子一定在同一个平面内
D.O4分子中的原子构成一个四边形
二、填空题(共16分)
25.(4分)
3L 0.5mol/L盐酸溶液与3L 0.55mol/LNaOH溶液完全反应,放出85.9kJ的热量,由此可推知盐酸与NaOH溶液发生反应的中和热为 ,表示该反应的热化学方程式为 。
26.(6分)
书写下列离子反应方程式:
(1)已知氧化性:Cl2>IO3—>I2,现将KI溶液逐滴滴入过量的饱和氯水中,边滴边振荡,可观察到以下现象:滴入KI溶液后首先看到溶液变黄色,振荡后立刻消失。请你写出有关反应的离子方程式:
① ;② 。
(2)向NH4HSO4浓溶液中,加入过量![]() 溶液并微热,写出发生反应的离子方程式:______________________________
_。
溶液并微热,写出发生反应的离子方程式:______________________________
_。
27.(2分)
下列各组微粒相互作用,结果形成离子键的是 。
① NH4+、OH- ②H+、CO32- ③Ba2+、SO42- ④H+、OH— ⑤HCl、NH3
28.(4分)
化合物A是一种不稳定物质,它的分子组成可用OxFy表示。10mL A气体能分解生成15mL O2和10mL F2(同温、同压下),已知A分子中X个氧原子呈…O-O-O…链状排列。请写出A分子的电子式和结构式并在结构式中标出每个原子的化合价。
A分子的电子式 ;A分子的结构式和每个原子的化合价 。
三、实验题(共10分)
29.(6分)
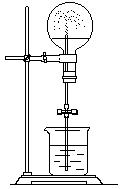 请回答下列问题:在仪器
①漏斗;②容量瓶;③蒸馏烧瓶;④分液漏斗;⑤烧杯;⑥蒸发皿;⑦玻璃棒;⑧酒精灯中,用于粗盐提纯实验的有
;用于分离两种沸点接近且互不相溶的液态混合物实验的有
;用于配制一定量物质的量浓度溶液实验的有
(以上3空都填写序号)。
请回答下列问题:在仪器
①漏斗;②容量瓶;③蒸馏烧瓶;④分液漏斗;⑤烧杯;⑥蒸发皿;⑦玻璃棒;⑧酒精灯中,用于粗盐提纯实验的有
;用于分离两种沸点接近且互不相溶的液态混合物实验的有
;用于配制一定量物质的量浓度溶液实验的有
(以上3空都填写序号)。
30.(4分)
根据以下提供的试剂与仪器、用品设计喷泉实验。
试剂:浓氨水、水。
仪器用品:铁架台(含铁夹)、烧瓶、带导管的单孔塞、玻璃导管和橡胶管、烧杯、酒精灯。
若按右图装置进行喷泉实验,请在以下已有操作的基础上补齐其它操作。
(1)往烧瓶中滴入5-6滴浓氨水,然后旋转烧瓶,使氨水润湿烧瓶内壁,然后, 。
(2)快速用带玻璃管的橡皮塞塞紧烧瓶。并按右图装置装配好。
(3) ,水进入烧瓶,即可形成喷泉。
四、推断题(共16分)
31.(6分)
X、Y、Z三种元素位于周期表前18号元素之中。已知:①X2Y2和Z2Y反应生成Y2和化合物XYZ;②X的氧化物和Z2Y也生成XYZ;
请写出:
(1)Z2Y2的结构式为 ,XYZ的电子式为 。
(2)反应①的化学方程式为 。
32.(10分)
利用海水可制得多种化工产品。下图是以海水、贝壳等为原料制取几种化工产品的转化关系图,其中E是一种化肥,N是一种常见的金属单质。
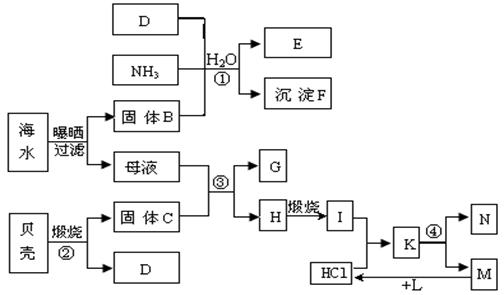
试填写下列空白:
(1)N的原子结构示意图为 ;
(2)写出下列反应的化学方程式:
① ;
② ;
③ ;
④ 。
五、计算题(10分)
33.(6分)
一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,生成XO2和YO2气体。冷却后,在标准状况下,测得生成物的体积是672mL,密度为2.56g/L,则:
(1)反应前O2的体积是______ _;(2)化合物XY2的摩尔质量是_______ ;
(3)若XY2分子中X、Y两元素的质量比为3:16,则XY2是____ _分子(填“极性”或“非极性”)。
34.(4分)
某工厂排出的废水,经测定含0.012mol·L-1的游离Br2和8×10-4mol·L-1的H+。若用加Na2SO3的方法除去Br2,现处理这种废水5L,问:
①需加入0.05mol·L-1的Na2SO3溶液多少升才能把Br2除尽?
②除尽以后的废水,其PH是多少?
(提示:①溶液的体积变化忽略不计 ②lg5=0.70 )
化学参考答案
一、选择题(每小题只有一个选项符合题意,2分×24=48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | B | B | D | D | D | B | B | D | C | C | C | D |
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| 答案 | D | C | D | B | B | A | D | D | B | D | D | D |
二、填空题(共16分)
25.(4分)
57.26kJ/mol , HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-57.26kJ/mol ;
26.(6分)
(1)①Cl2+2I-=2Cl-+I2 ②5Cl2+I2+6H2O=10Cl-+2IO3-+12H+
(2)NH4++H++SO42-+Ba2++2OH-
![]() NH3↑+2H2O+BaSO4↓
NH3↑+2H2O+BaSO4↓
27.(2分)
③⑤
28.(4分)
![]()
![]()
三.实验题(共10分)
29.(6分 各小题全对得2分、漏写或错写得0分)
①⑤⑥⑦⑧ ④⑤ ②⑤⑦
30.(4分)
(1)用酒精灯给烧瓶(微微)加热
(3)稍冷后,打开止水夹
四、推断题(共16分)
31.(6分)
(1)H-O-O-H
![]()
(2)2Na2O2 + 2H2O = 4NaOH + O2↑
32.(10分)
(1)N的原子结构示意图为![]() ;
;
(2)写出下列反应的化学方程式:
① NaCl+NH3+CO2+H2O==NaHCO3↓+NH4Cl ;
② CaCO3 ![]() CaO+CO2↑;
CaO+CO2↑;
③ MgCl2 + CaO + H2O = Mg(OH)2↓+ CaCl2;
④ MgCl2(熔融) ![]() Mg + Cl2↑。
Mg + Cl2↑。
五、计算题(10分)
33.
(1)672mL(2分)
(2)76g/mol(2分)
(3)非极性 (2分)
34.
(1)1.2L (2分)
(2)PH=1.7 (2分)