高三年级化学第一学期阶段性测试试卷
考试时间120分钟 分值150分 命题:黄燕鹏
Ⅰ卷选择题 共64分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Fe-56
Al-27
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列说法不正确的是( )
A.“钴酞菁”分子所形成的分散系具有丁达尔效应
B.“钴酞菁”分子既能透过滤纸,也能透过半透膜
C. 此项工作可以用来改变分子的某些物理性质
D. 此工作可广泛应用于光电器件、生物技术等方面
2.奥运吉祥物福娃外材为纯羊毛线,内充物为无毒的聚酯纤维(![]() )下列说法不正确的是
)下列说法不正确的是





A.羊毛与聚酯纤维的化学成分不相同 B.聚酯纤维和羊毛一定条件下均能水解
C.该聚酯纤维单体为对苯二甲酸和乙二醇
D.由单体合成聚酯纤维的反应属加聚反应
3.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述不正确的是( )
A.氯化硼液态时能导电而固态时不导电 B.氯化硼加到水中使溶液的pH降低
C.氯化硼分子呈正三角形,属非极性分子 D.氯化硼遇水蒸气会产生白雾
4.常温下,浓度为0.1 mol/L的一元酸HA溶液的pH=2.0,浓度为0.1 mol/L的一元碱BOH溶液中c(H+):c(OH—)=1.0×10-12。将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是( )
A.c(OH-)>c(H+)>c(B+)>c(A-) B.c(H+)>c(OH-)>c(B+)>c(A-)
C.c(B+)>c(A-)>c(OH-)>c(H+) D.c(B+)>c(A-)>c(H+)>c(OH-)
5.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.6.2克白磷分子中含P—P键为0.6NA
B.10.0 mL 18.0mol/L的浓硫酸中氢离子数为0.36 NA
C.6.4gS6与S8的混合物中所含S原子数一定为0.2 NA
D.80mL 10mol·L—1浓盐酸与足量MnO2反应,转移电子数为0.4NA
6.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中正确的是( )
A.氢气燃烧的热化学方程式: 2H2(g)+ O2(g)=2H2O(l); △H= +570kJ·mol-1
B.甲烷碱性燃料电池的负极反应: CH4+10OH--8e-= CO32-+7H2O
C.饱和FeCl3溶液滴入沸水中的反应: FeCl3+3H2O = Fe(OH)3↓+3HCl↑
D.次氯酸钙溶液中通入过量的SO2: ClO-+ H2O + SO2 =HSO3-+ HClO
7.某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为( )
A.11.2克 B.16.8克 C.19.6克 D.22.4克
8.过氧化氢俗称双氧水,它是一种液体,易分解,常作氧化剂、漂白剂,为贮存、运输、
使用的方便,YC工业上常将H2O2转化为固体的过碳酸钠(化学式为:2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是( )
A.MnO2 B.H2S C.NaHCO3 D.稀HCl
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.下列各组离子在所给条件下能大量共存的是( )
A.在滴加酚酞试液呈红色的溶液中:![]()
B.在pH=0的溶液中:![]()
C.由水电离出的c(H+)=1×10-12mol/L的溶液中:![]()
D.加入单质硅能产生H2的溶液中:![]()
10.500mL KNO3和Cu(N03)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为2 mol·L-1 B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为2 mol·L-1
|
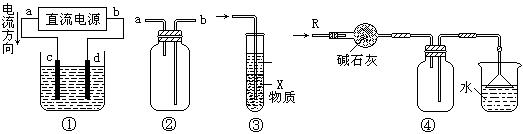 11.关于下列各装置图的叙述中,不正确的是( )
11.关于下列各装置图的叙述中,不正确的是( )
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
12.已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1 mol·L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+) = c(HRO3-)+ c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3) = c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
13.恒温下,将两个铂电极插入一定量的Na2SO4饱和溶液里进行电解,经过一段时间后,在阳极逸出n mol气体,同时从溶液中析出m g Na2SO4·10H2O晶体,则原Na2SO4溶液的质量分数为( )
A.![]() B.
B.![]()
 C.
C.![]() D.
D.![]()
14.可逆反应aX(g)+bY(g)![]() cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是( )
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是( )
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是加入了催化剂
D.若a+b≠c,则t0时只能是增大了容器的压强
15.向一定量的Fe、Fe3O4的混合物中,加入200mL 1mol/L的盐酸,恰好使混合物完全溶解,放出448mL(S、T、P)的气体。所得溶液中加入KSCN溶液无血红色出现,混合物中铁元素的质量分数为( )
A.68.6% B.81.4% C.77.8% D.无法计算
16.微型钮扣 电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH―-2e-=ZnO+H2O ,Ag2O+H2O+2e-=2Ag+2OH-,总反应为:Ag2O+Zn=2Ag+ZnO。根据上述反应式,下列叙述中正确的是
A.在使用过程中,电池负极区溶液pH增大
B.在使用过程中,电流由Ag2O极经外电路流向Zn极
C.在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应
D.外电路中每通过0.2mol电子,正极的质量理论上减小1.6g
Ⅱ卷非选择题 共86分
三、本题包括17、18两小题,共22分:
17.(6分)下列实验操作或对实验事实的描述不正确的是____________________(填序号,错选一个倒扣2分,不出现负分)
① 用量筒量得稀硫酸溶液8.0mL;②用热的浓HCl洗涤附着有MnO2的试管;③在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 ;④ Fe(OH)3胶体与FeCl3溶液可用过滤的方法分离;⑤用碱式滴定管量得KMnO4溶液20.50mL ;⑥ 实验室快速制备少量H2、O2、NH3、HCl可以用同一种气体发生装置;⑦配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
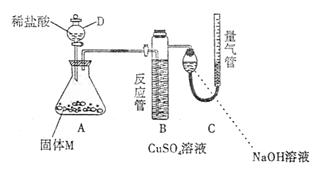 18.(16分)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了下图所示装置。打开分液漏斗D中活塞,缓慢加入稀盐酸至过量,与固体M充分反应。待反应停止后,B中有黑色沉淀析出,C中量气装置右边液面上升,调节量气装置使左右液面相平后,测得进入C中的气体为V mL(已换算成标准状况)。
18.(16分)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了下图所示装置。打开分液漏斗D中活塞,缓慢加入稀盐酸至过量,与固体M充分反应。待反应停止后,B中有黑色沉淀析出,C中量气装置右边液面上升,调节量气装置使左右液面相平后,测得进入C中的气体为V mL(已换算成标准状况)。
根据上述实验事实,回答下列问题:
(1)加入药品和实验开始前必须进行的操作是 。
(2)固体M中一定有的物质是 (写化学式)。
(3)写出A中发生反应的化学方程式(只写一个):
。
(4)写出B中析出黑色沉淀时发生反应的离子方程式 。
(5)根据题给条件,固体M中一种物质的质量可以确定,应为 g(用代数式表示)。
(6)稀盐酸与固体M反应后还残留淡黄色固体,该固体可能是 (写化学式),要分离该固体,在实验操作中,除烧杯、玻璃棒外,还需要的玻璃仪器是 。
(7)反应完成后,取A中溶液少许加入试管中,要确定固体M中是否含有Fe3+,需加入的试剂为: 。
A.KSCN溶液 B.NaOH溶液 C.氨水
四、本题包括三小题,共30分:
19.(10分)下图是元素周期表中的一部分,表中所列字母分别代表一种化学元素,请回答下列问题:
| a | b | ||||||||||||||||
| c | m | d | e | ||||||||||||||
| f | g | h | i | ||||||||||||||
| j | |||||||||||||||||
| k | l |
⑴上述所列元素的原子中,最外层电子层上只有两个电子的是___________ (填“元素符号”).
⑵下列叙述正确的是__________________.
A.k的最高价氧化物对应的水化物是一种强碱
B.硒化氢的稳定性强于h的氢化物的热稳定性
C.f与h形成化合物水溶液的pH大于f与i形成化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性h弱于i
D.原子半径:k>g>e>a
⑶m元素的单质中有一种称为足球烯的分子m60,它可能最易发生的反应是 。
A.消去反应 B.取代反应
C.加成反应 D.聚合反应
⑷由a、d、e三种元素形成的化合物中,能促进水电离的是__________________(填一种物质的化学式,下同);能抑制水电离的是_______________; 最近科学家们合成了dn+5,电子式为![]() ,则n值为
。
,则n值为
。
⑸将等物质的量的f、g的单质投入足量水中,向反应后的溶液中逐滴加入浓度为1 mol·L-1的盐酸溶液,至100 mL时沉淀达到最大值,则投入f的物质的量为________mol.
20.(12分)甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族,丙为无色气体。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同。G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图:
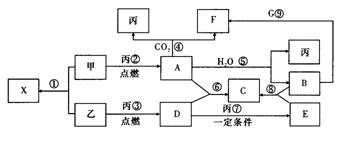
请回答:
(1)丙的名称为 ,C的化学式为 ,X的电子式为 。
(2)写出A与X 的溶液反应的化学反应方程式 。
(3)写出B与G溶液反应的离子方程式: 。
(4)在上图的反应中,不属于氧化还原反应的是(填序号) __________。
21.(8分)A、B、C、D、E 5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和AgNO3中的一种。已知:
①A与B反应有气体生成 ②B与C反应有沉淀生成
③C与D反应有沉淀生成 ④D与E反应有沉淀生成
⑤A与E反应有气体生成 ⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式(分子式)是 。
(2)A是 ,B是 ,C是 ,D是 ,E是 。
(3)A与E反应的离子方程式是 。
五、本题包括22、23两小题,共17分:
22.(8分)A、B都是芳香族化合物。1 mol A和1 mol某一元羧酸发生酯化反应生成B。B能在一定条件下发生银镜反应而A不能;A、B的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O;A中氧元素的质量分数为31.6%,B的溶液有酸性但不能和FeCl3溶液发生显色反应。
(1)A、B相对分子质量的差值为_______________________________。
(2)一个A的分子中应有________个(选填2、3、4)氧原子,作出此判断的理由是:_______ __________________________________________。A的分子式是:____________。
(3)B的同分异构体甚多。其中不属于酚类且l mol能与4 mol NaOH反应的同分异构体的结构简式为:______________________________________(任写一种)。
|
 的格利雅试剂而荣获诺贝尔化学奖。格利雅试剂用卤代烃和金属镁在醚类溶剂中反应制得。
的格利雅试剂而荣获诺贝尔化学奖。格利雅试剂用卤代烃和金属镁在醚类溶剂中反应制得。
![]()
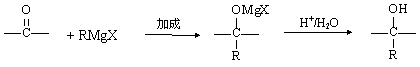 设R为烃基,已知RX
+ Mg
RMgX(格利雅试剂)
设R为烃基,已知RX
+ Mg
RMgX(格利雅试剂)
阅读以下合成路线图,回答有关问题:
|
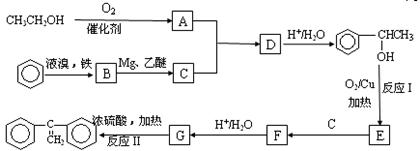
⑴写出A、C、E的结构简式
A_____________________、C_____________________、E_____________________
⑵写出以下反应的化学方程式
反应I_________________________________________________,反应类型___________
反应II________________________________________________,反应类型___________
六、本题包括23、24两小题,共18分:
24.(6分)在常温下的真空密闭容器中放入1.56gNa2O2,然后通入O2,再通入C2H6用电火花引爆,直至反应完全,恢复至原温度,此时容器内压强近似为零,且生成物中无酸式盐。试解答下列问题:
⑴求通入O2和C2H6的物质的量之比。 ⑵通入O2的质量最多不能超过多少克?
25.(11分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
I.⑴某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理)
⑵设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______________,反应的离子方程式为_________________________________。
⑶实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
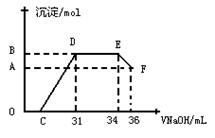 II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
⑴图中OC段没有沉淀生成,此阶段
发生反应的离子方程式为__________________________________。
⑵在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为_____________________________;
上述现象说明溶液中_________________结合OH-的能力比_______强(填离子符号)。
⑶B与A的差值为_________mol。
⑷B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为___________mL
1.B 2.D 3.A 4.C 5.C 6.B 7.A 8.C 9.A 10.AB 11.A 12.C 13.B 14.C 15.B 16.BD
17.④ ⑤ ⑦(6分,选对一个得2分,错选一个倒扣2分,不出现负分)
18.(16分,每空2分)
(1)检查装置的气密性(2分)
(2)FeS、 Fe(2分)
(3)![]() (2分)
(2分)
(4)![]() (2分)
(2分)
(5)![]() (2分)
(2分)
(6)S 漏斗(每空2分,共4分)
(7)a(2分)
19.(10分)⑴He、Be、Fe (2分) ⑵ ACD (2分) ⑶ C (1分)
⑷NH4NO3 HNO3 1 (3分) ⑸ 0.1(2分)
|
(2)Na2S + Na2O2+2H2O =
4NaOH+S (3)OH-+HCO![]() =CO
=CO![]() +H2O
+H2O
(4)⑧⑨
21.(8分)
(1)AgCl
(2)A:Na2CO3 B:HCl C:AgNO3 D:BaCl2 E:NaHSO4
(3)2H++CO32-===CO2+H2O↑
22.(8分)⑴28 (1分),(2) 3 (1分),A中至少有一个-OH和一个-COOH;但若氧原子数大于等于4,则M(A)>200 (2分),C8H8O3 (2分),⑶![]() (2分)(合理答案即给分)
(2分)(合理答案即给分)
23.(9分)
⑴CH3CHO ![]()
![]() (每空1分)
(每空1分)
⑵ 2![]() +O2→2
+O2→2![]() +2H2O 氧化反应 (2+1分)
+2H2O 氧化反应 (2+1分)
⑶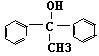 →
→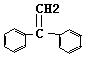 +H2
O 消去反应
(2+1分)
+H2
O 消去反应
(2+1分)
24.(6分)⑴1:1≤n(O2):n(C2H6)≤2.5:1
⑵ 0.8g
25.(11分)Ⅰ⑴合理 ⑵NaOH溶液 2Al+2NaOH+H2O=2NaAlO2+3H2↑
⑶B
Ⅱ⑴H++OH-=H2O ⑵ NH4++OH-=NH3·H2O
Al3+、Fe3+、 H+ , NH4+; ⑶0.008 ⑷0.032mol 7mL