![]()
 高三年级化学第二次月考试卷
高三年级化学第二次月考试卷
原子量: H:1 O:16 S:32 Cl:35.5 I:127 Na:23 Cu:64
第Ⅰ卷(共44分)
一、选择题:(本题包括10小题,每题2分,共20分。每小题只有1个正确选项符合题意。)
1.通过分析周期表结构和各元素性质的变化趋势,判断砹(原子序数为85)及其化合物的叙述正确的是( )
A. 由KAt的水溶液制备At的化学方程式为2KAt + Cl2 == 2KCl +At2
B.相同条件下,HAt比HI难分解
C.AgAt是一种易溶于水的固体
D.At在第五周期VIIA族
2.某溶液中含有的溶质是FeBr2、FeI2,若向该溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为血红色,则下列叙述正确的是:( )
① 原溶液中的Br-一定被氧化
② 通入氯气后原溶液中的Fe2+一定被氧化
③ 不能确定通入氯气后的溶液中是否存在Fe2+
④ 若取少量所得溶液,加入CCl4,静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
A.①②③ B.②③④ C.①③④ D.①②③④
3.一定温度下,向质量分数为 a的乙腈(CH3CN)溶液中加入等体积水,所得溶液中乙腈质量分数为 0.4a ,则乙腈的密度(ρ1)与水的密度(ρ2)关系是( )
A.ρ1 >ρ2 B.ρ1 <ρ2 C.ρ1 =ρ2 D.无法确定
4. 某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:①将镁粉投入冷水中,未见任何现象;②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色全逐渐褪色;③将镁粉放入液溴中.未观察到任何明显现象;④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。则下列关于镁与溴水的反应机理的论述中正确的是( )
A.镁粉只直接与溴水中的溴反应
B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到
D.镁粉在水的催化下与溴发生反应
5. 在硫酸的工业制法中,下列生产操作及说明生产操作的主要原因二者都正确的是:( )
A.从沸腾炉出来的炉气须净化,因为炉气中SO2会与杂质发生反应
B.硫铁矿燃烧前需要粉碎,否则块状的硫铁矿石不能燃烧
C.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便使SO3吸收完全
D.SO2氧化为SO3时需使用催化剂,这样可以提高SO2的转化率
6.有一铁的“氧化物”样品,用5mol/L盐酸140mL恰好完全溶解,所得溶液还能吸收标况下0.56L氯气,使其中Fe2+全部转化为Fe3+。该样品可能的化学式是( )
A、Fe2O3 B、Fe3O4 C、Fe4O5 D、Fe5O7
![]() 7.相对分子质量为M的某物质,在室温下溶解度为S g,此时测得该物质饱和溶液的密度为ρ g/cm3,则该饱和溶液的物质的量的浓度是( )
7.相对分子质量为M的某物质,在室温下溶解度为S g,此时测得该物质饱和溶液的密度为ρ g/cm3,则该饱和溶液的物质的量的浓度是( )
A. mol/L B. mol/L C. mol/L D. mol/L
8.某无色气体可能含有H2S、SO2、CO2、HI、HCl气体中的一种或几种。将气体通入氯水
后得无色溶液,向该溶液中滴加氯化钡溶液产生白色沉淀。则下列叙述正确的是( )
A.该气体中肯定含有H2S和SO2 B.该气体中肯定含有SO2
C.该气体中肯定含有CO2和SO2 D.该气体中肯定含有H2S、CO2和HI
9.充分煅烧黄铁矿Wg,反应完全后冷却至室温,称得固体物质的质量是mg,生成SO2为
VL,则黄铁矿中FeS2的质量分数是(假设矿石中的杂质受热不分解,也不会与SO2反应)( )
A.60V/22.4W B.22.4V/60W C.80V/22.4W D.3(W-m)/W
10. 将30℃时物质A的溶液136 g分成两等份,向其中一份加入10 gA,结果只溶解了2 g
就不再溶解;将另一份溶液降温至0℃析出A 5.5 g,此时溶液中A的质量分数为20%,已
知A中不含结晶水,则A在30℃的溶解度为( )
A.10 g B.20 g C.30 g D.40 g
二、选择题:(本题包括8小题,每题3分,共24分。每小题有一个或两个选项符合题意。)
11.下列离子方程式书写正确的是( )
A.将6molCl2通入含有5molFeI2的溶液中:6Cl2+2Fe2++10I-==12Cl-+5I2+2Fe3+
|
NH4++HSO3-+Ba2++2OH-==== NH3↑+2H2O+BaSO3↓
|
D.电解饱和 MgCl2 溶液:Cl-+2H2O=== 2OH-+H2↑+Cl2↑
12.下列褪色过程不是因为氧化还原反应而褪色的是( )
A.SO2气体通入到溴水中使溴水褪色。
B.氯水使滴有酚酞的NaOH溶液褪色,加入NaOH后不变红。
C.将SO2气体通入到滴有酚酞的NaOH溶液中,溶液褪色。
D.在含有碘单质的淀粉溶液中,加入KOH溶液后蓝色褪去。
13.关于某无色溶液中所含离子的鉴别,下列判断正确的是( )
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
![]()
 14.下列有关气体体积的叙述中,正确的是( )
14.下列有关气体体积的叙述中,正确的是( )
A.在一定的温度和压强下,各种气态物质体积大小由构成气体分子大小决定
B.在一定的温度和压强下,各种气态物质体积的大小由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数一定不同
D.气体摩尔体积是指1 mol任何气体所占的体积约为22.4L
15.常温下跟镁粉、溴水、臭氧、硝酸都能发生氧化还原反应的是( )
A.![]() 溶液 B.
溶液 B.![]() 溶液 C.
溶液 C.![]() 溶液 D.NaOH溶液
溶液 D.NaOH溶液
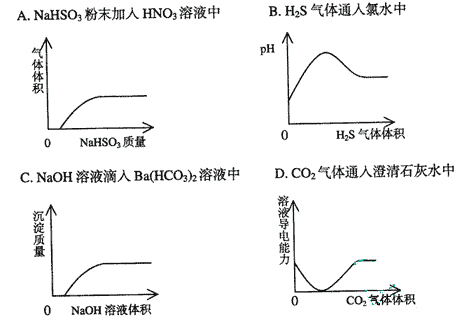
16.下列实验过程中产生的现象与对应的图形相符合的是 ( )
17.由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生
Cl2。下列关于混盐CaOCl2的有关判断不正确的是( )
A.该混盐与硫酸反应产生1 mol C12时转移2NA个电子
B.该混盐的水溶液呈中性
C.该混盐具有较强的氧化性
D.该混盐中的氯元素的化合价为+1和—1
18.在含大量I-的溶液中,因发生氧化还原反应而不能大量共存的时是( )
A.Mg2+、Ag+、HCO3-、Cl- B.H+、AlO2-、Cl-、SO42-
C.K+、Fe3+、SO42-、Br- D.H3O+、Ca2+、Cl-、NO3-
第Ⅱ卷(共56分)
三、填空题: (共 24 分)
19.新浪网曾经报道,重庆开县发生特大井喷事故,造成大量人员牲畜伤亡。其中罪魁祸首是喷出大量的有毒气体H2S,为了解毒,政府采用了点燃的方法,写出完全燃烧的化学方程式 ,但是会造成空气污染,易形成________。
20. 设NA为阿伏加德罗常数。下列说法正确的是
①标准状况下,22.4 L SO3所含分子数为NA。 ②常温常压下,16 g O2和O3的混合气体所含氧原子数为NA。 ③12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2 NA。 ④含1molFeCl3的溶液中,Fe3+离子的数目为NA。 ⑤7.8 g Na2O2含有的阴离子数目为0.1 NA。 ⑥0.05mol熔融的KHSO4中含有0.1NA个阳离子。 ⑦4 g重水(D2O)中所含质子数为2 NA。 ⑧电解精炼铜时转移0.1NA个电子时阳极溶解3.2g铜。
21. 据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出
了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构。
(1)下列有关O4的说法正确的是
A.O4分子内存在极性共价键
B.合成O4的反应可看作核聚变反应,即不属于化学变化
C.O4与O3、O2都是氧的同素异形体
D.O4将来可用作更强有力的火箭推进的氧化剂
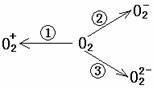 (2)制备O
(2)制备O![]() 、O
、O![]() 甚至O
甚至O![]() 的化合物是可能存在的,通常它们是在氧分子进行下列各种反应时生成的:
的化合物是可能存在的,通常它们是在氧分子进行下列各种反应时生成的:
上述反应中, (填序号)相当于氧分子的氧化; (填序号)相当于氧分子的还原。
(3)写出O22-的电子式: 。
(4)O2[PtF6]是一种含有O![]() 的化合物,请写出一种含有O
的化合物,请写出一种含有O![]() 的氧化物的化学式:
的氧化物的化学式:
22.氯酸(HClO3) 是一种强酸,氯酸的浓度超过40%,就会迅速分解,产生比它的酸性更强的含氧酸,同时放出气体,该气体混合物经干燥后,平均相对分子质量为47.6,它可以使带火星的木条复燃,并可使润湿的淀粉一碘化钾试纸变蓝后又褪色。试完成下列各题:(已知有关物质的氧化性顺序为:Cl2>IO3->I2)
(1)该气体的组成是________________,气体混合物的物质的量比为 。
(2)写出氯酸分解方程式并配平
![]()
 该反应的还原产物是________________ (写化学式)
该反应的还原产物是________________ (写化学式)
(3)结合化学反应方程式解释,该气体使润湿的淀粉一碘化钾试纸变蓝后又褪色的原因:______________________________,___________________________________。
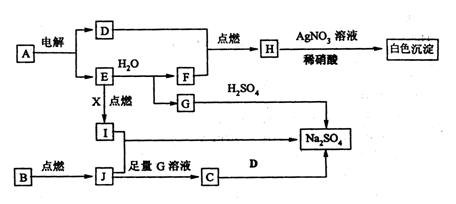 23.下图中每个方框表示有关的一种反应物或生成物,方框中字母是物质代号,已知B、D、E、F、X均为单质,试填空。
23.下图中每个方框表示有关的一种反应物或生成物,方框中字母是物质代号,已知B、D、E、F、X均为单质,试填空。
(1)写出A、B的化学式:A ,B 。
(2)写出I和J反应的化学方程式 。
写出E和H2O反应的离子方程式 。
(3)写出C溶液和D反应的离子方程式 。
24.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2 。
已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目 。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 。
四、实验题:(共 16 分)
25. 硫酸工业测量尾气SO2、N2、O2的混合气体中SO2含量的装置如下图;反应管中装有
碘的淀粉溶液。SO2和I2发生的反应为:SO2+I2+2H2O H2SO4+2HI (N2、O2不与I2反
应)
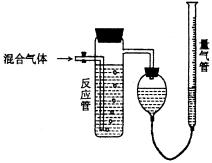 ⑴ 混合气体进入反应管后,量气管内增加的水
⑴ 混合气体进入反应管后,量气管内增加的水
的体积等于 的体积(填写气体的分子式)
⑵ 反应管内溶液蓝色消失后,没有及时停止
通气,则测得的SO2含量
(选填:偏高,偏低,不受影响)
⑶反应管内的碘的淀粉溶液也可以用
代替(填写物质名称)
⑷ 若碘溶液体积为Va mL,浓度为c mol·L-1,N2与O2的体积为Vb mL(已折算为标准状况下的体积)。用c、Va、Vb表示SO2的体积分数为: 。
⑸ 将上述装置改为简易实验装置,除导管外,还需选用的仪器为 : (选下列仪器的编号)a.烧杯 b.双孔塞 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞
五、计算题:(共 6 分)
26、向Na2S2O3和Na2S的混合液中缓慢加入足量的稀H2SO4,完全反应后,得到3.2g沉淀和336ml标准状况下气体,溶液总体积为100ml,溶液中H2S的浓度为0.100mol/L。
(1)写出各反应的化学方程式; (2)求原混合溶液中Na2S2O3和Na2S的物质的量。
![]()
 答 案 纸
答 案 纸
一、二、选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
三、填空题:
19、 , 。
20、 。
21、(1) 。 (2) , 。
(3) 。 (4) 。
22、(1) , 。
(2) , 。
(3) ,
。
23、(1)A ,B 。
(2) 。
。
(3) 。
24、(1) 。 (2) , 。
(3) 。
(4) 。
四、实验题:
25、(1) 。 (2)
(3) 。
(4) 。(5) 。
五、计算题:
26、解:
参考答案
一、二、选择题:(共44分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | A | B | B | D | C | D | B | B | D |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | AB | C | C | B | AC | D | AB | CD |
三、填空题:(共40分)
19、2H2S+3O2 2SO2+2H2O 酸雨
 20、②⑤⑦
20、②⑤⑦
21、(1)CD(2)①;②③(3)[: O : O :]2- (4)KO2
22、(1)O2和Cl2 ;3︰2 (2)8HClO3 3O2↑+2Cl2↑+4HClO4+2H2O
(3)Cl2+2I- 2Cl-+I2,淀粉遇I2变蓝;又5Cl2+I2+6H2O 10Cl-+2IO3-+12H+
23、(1)NaCl S
(2)Na2O2+SO2 === Na2SO4 2Na+2H2O === 2Na++2OH-+H2↑
(3)SO![]() +Cl2+H2O=== SO
+Cl2+H2O=== SO![]() +2H++2Cl-
+2H++2Cl-
24、(1)H2O2 (2)H2CrO4 Cr(OH)3
(3) (4)3.36L
四、实验题:(共10分)
25、(1)N2、O2的体积 (2)偏低 (3)酸性高猛酸钾溶液或溴水。
(4)22.4cVa/(22.4cVa+Vb)(其它合理答案也给分)(5)bce
五、计算题:(共6分)
26、解:(1)Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
Na2S+H2SO4=Na2SO4+H2S↑
2H2S+SO2=3S↓+2H2O
(2)设Na2S2O3的物质的量为xmol
Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O 2H2S+SO2=3S↓+2H2O
x x x 2x x 3x
n(S)==x+3x=0.1mol,有n(Na2S2O3)=x=0.025mol
n(Na2S)= n(H2S,出沉淀的)+ n(H2S,溶于水的)+n(H2S,逸出的)
=2x+0.01+0.015=0.075mol