高三化学阶段性测试试卷
可能用到的相对原子质量:H-1 He-4 C-12 N-14 O-16 Na -23 S-32 Cl-35.5 K-39 Fe-56 Cu-64
第Ⅰ卷(选择题 共64分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意.)
1.生活中碰到的某些问题常常涉及到化学知识,下列叙述中正确的有
①加碘食盐就是在其中加入碘单质;②用甲醛溶液浸泡海产食品;③用加酶洗衣粉洗涤毛料服装;④河海分界处易沉积成沙洲,是胶体遇电解质溶液聚沉的结果;⑤香肠中可以加大量的亚硝酸钠以保持肉类新鲜;⑥造成大气污染的SO2、CO和NO,主要来源于煤的燃烧和汽车排放的尾气;⑦用次氯酸钙净化不太澄清的井水;⑧变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应
A.④⑥ B.③⑥⑧ C.①② D.全部
2.科学家正拟合成一种“二重构造”的球形分子,即把足球型的C60分子熔进Si60的分子中,外面的硅原子与里面的碳原子以共价键结合。关于这种分子的下列说法,正确的是
A.它是两种单质组成的混合物 B.它是一种硅酸盐
C.它是一种新型化合物 D.它是一种高聚物
3.下列除去杂质的实验方法正确的是
A.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
B.除去乙烷中溶有的少量乙烯:在一定条件下加入适量氢气充分反应
C.除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置
D.除去蛋白质溶液中混入的少量氯化钠:加AgNO3溶液后过滤
4.“类推”是一种常见的学习方法,但有时也会产生错误的结论,下列类推结论中正确的是
A.IVA族元素的气态氢化物沸点顺序是GeH4>SiH4>CH4,则VA族元素的气态氢化物沸点顺序是AsH3> PH3 >NH3
B.第二周期元素的气态氢化物的稳定性顺序是HF>H2O>NH3,则第三周期元素的气态氢化物的稳定性顺序是HCl>H2S>PH3
C.晶体中有阴离子必有阳离子,则晶体中有阳离子必有阴离子
D.干冰属于分子晶体,则水晶也属于分子晶体
5.胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得,101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式书写正确的是
A.CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH= -890.3 kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=+890.3 kJ·mol-1
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g);ΔH=-890.3 kJ
D.2H2(g)+O2(g)=== 2H2O(l);ΔH=-285.8 kJ
6.有M、N两溶液,各含有下列十四种离子中的七种离子:Al3+、Cl—、Na+、K+、NO3—、OH—、S2—、MnO4—、Fe3+、NH4+、H+、SO42—、CO32—、AlO2—。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是
A.OH—、S2—、CO32— B.MnO4—、SO42—、NO3—
C.Cl—、NO3—、SO42— D.AlO2—、MnO4—、SO42—
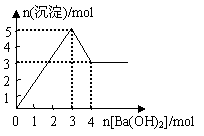 7.右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量
7.右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量
随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
A.MgSO4 B.KAl(SO4)2
C.Al2(SO4)3 D.NaAlO2
8.某有机物结构简式为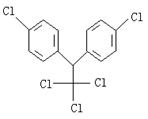 ,有关它的说法正确的是
,有关它的说法正确的是
A.它属于芳香烃 B.分子中最多有22个原子共面
C.分子式为![]() D.1mol该物质能与6mol H2加成
D.1mol该物质能与6mol H2加成
二、选择题(本题包括8小题,每小题4分,共32分.每小题有一个或两个选项符合题意.若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要多选或错选,该小题就为0分.)
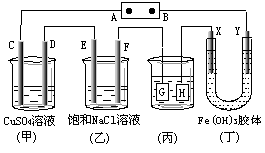 9.如下图所示的装置,C、D、E、F、X、Y都是
9.如下图所示的装置,C、D、E、F、X、Y都是
惰性电极。将电源接通后,向(乙)中滴入酚酞
溶液,在F极附近显红色。则以下说法正确的是
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质
生成,其物质的量比为1∶2∶2∶2
C.欲用(丙)装置给铜镀银,G应该是Ag,电镀液选是AgNO3溶液
D.装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶粒带负电荷
10.设NA为阿伏加德罗常数的值,下列叙述错误的是
A.4g氦气所含的原子个数为NA
B.1mol甲基(·CH3)所含的电子数为9NA
C.1mol CnH2n+2所含的共用电子为(3n+1)NA对
D.标准状况下,2.24L SO3中含有的氧原子数为0.3NA
11.下列反应的离子方程式书写正确的是
A.等体积等物质的量浓度的氢氧化钡溶液与明矾溶液混合:
Ba2++3OH-+Al3++ SO42-=BaSO4↓+Al(OH)3↓
B.向苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
C.向硫代硫酸钠溶液中滴入过量稀硫酸:4H++2S2O32-=3S↓+ SO42-+2 H2O
|
12.某溶液中只含有Na+、H+、OH—、A—四种离子,下列说法正确的是
A.若溶液中c(A—)== c(Na+),则溶液一定呈中性
B.溶液中不可能存在:c(Na+)>c (A—)>c(OH—)>c(H+)
C.若c(OH—)>c(H+),溶液中不可能存在:c(Na+)>c(OH—)>c(A—)>c(H+)
D.若溶质为NaA、HA,则一定存在: c(A—)>c(Na+)>c(H+)>c(OH—)
13.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
![]()
下列说法中不正确的是
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
14.恒温下,容积均为2L的密闭容器M、N中,分别以下列两种起始投料建立的可逆反应3A(g) + 2B(g) ![]() 2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3molA、2molB;2min达到平衡,生成D1.2mol,测得从反应开始到平衡C的速率为0.3mol/Lmin。N:2molC、ymolD;达到平衡时c(A)=0.6mol/L。下列推断的结论中不正确的是
2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3molA、2molB;2min达到平衡,生成D1.2mol,测得从反应开始到平衡C的速率为0.3mol/Lmin。N:2molC、ymolD;达到平衡时c(A)=0.6mol/L。下列推断的结论中不正确的是
A.x=2 B.平衡时M中c(A)< 0.6mol/L C.y> 0.8 D.y< 0.8
15.现有下列短周期元素性质的数据:
|
元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
下列说法正确的是
A.原子序数④元素大于⑦元素
B.②、③处于同一周期
 C.上述八种元素最高价氧化物对应的水化物,⑤号酸性最强
C.上述八种元素最高价氧化物对应的水化物,⑤号酸性最强
D.⑧号元素原子结构示意图为:
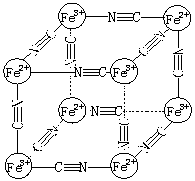 |
16.某蓝色晶体化学式可表示为:MxFey(CN)z
。用X射线研究其结构
特征如右图所示:Fe2+和Fe3+分别占据立方体的顶点且互不相邻,
而CN— 位于立方体的棱上。则下列说法正确的是
A.该晶体是共价化合物
B.该晶体的化学式可表示为MFe2(CN)6
C.该晶体中既有离子键、又有极性共价键
D.M的离子位于上述晶胞体心,呈+2价
第II卷(选择题 共86分)
三、(本题包括2小题,共19分)
17.(4分)请按要求填空:
下列实验操作或对实验事实的叙述正确的是__________________(填序号)
①用稀硝酸清洗做过银镜反应实验的试管;
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加到浓硝酸中,并不断搅拌;
③用碱式滴定管量取20.00mL 0.1000mol/L KMnO4溶液;
④用托盘天平称取10.50g干燥的NaCl固体;
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥用瓷坩埚高温熔融NaOH和Na2CO3的固体混合物;
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧配制Al2(SO4)3溶液时,加入少量的稀硫酸。
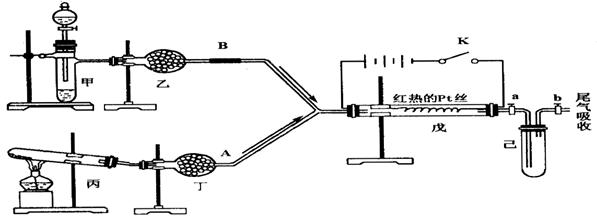
18.(15分)研究性学习小组设计了如右图所示的实验装置,进行气体性质探究实验.图中箭头表示气体流向.A表示一种纯净、干燥的气体,B是另一种气体,反应进行一段时间后,装置己中有红棕色气体生成.实验中所用的药品和干燥剂只能从下列物质中选取:Na2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O、蒸馏水。
根据图中装置和反应现象请回答:
⑴丙中发生反应的化学方程式为:________________ 。
⑵丁中的干燥剂应选 : _______,不选另一种干燥剂的理由是: _____________ 。
⑶甲中发生反应的化学方程式为:________________________________ 。
⑷戊中发生的主要反应的化学方程式为:_____________________________,此反应是(吸热、 放热) ______ 反应,可能发生的什么现象可以证明你的判断: ______________________ 。
⑸当己中充满红棕色气体后,停止给丙加热,并关闭a、b两个活塞,若将己浸入冰水中,则己中会出现的现象是:__________ ,简述产生此现象的原因:______________________________。
四、(本题包括3小题,共26分)
19.(10分)现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10mL的甲溶液,加入等体积的水,醋酸的电离平衡 移动(填“向左”、“向右”或“不”);另取10mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将 (填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲) pH(乙)(填“大于”、“小于”或“等于”)。
(3)各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲) V(乙)(填“大于”、“小于”或“等于”)。
(4)取25mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+) c(CH3COO-)(填“大于”、“小于”或“等于”)。
 20.(8分)有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A 和B原子有相同的电子层数, 且A的最外层电子数是次外层电子数的两倍;C燃烧时呈现黄色火焰, C的单质在加热条件下与B的单质反应, 可以得到与D单质颜色相同的固态化合物;D的最高价与最低价代数和为其最低价绝对值的两倍。试根据以上叙述回答:
20.(8分)有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A 和B原子有相同的电子层数, 且A的最外层电子数是次外层电子数的两倍;C燃烧时呈现黄色火焰, C的单质在加热条件下与B的单质反应, 可以得到与D单质颜色相同的固态化合物;D的最高价与最低价代数和为其最低价绝对值的两倍。试根据以上叙述回答:
(1)A与B形成最稳定化合物的结构式为 __________; 该化合物所含有的化学键属于__________键(填“极性”或“非极性”);该化合物的分子属于____________分子(填“极性”或“非极性”);
(2)用电子式表示C与B两元素可能形成的化合物______ _____。
(3)D的原子结构示意图为___________________,C与D两元素构成的化合物其水溶液显碱性的原因是(用离子方程式表示)______________________________________________。
21.(8分)下图所示反应有直接进行的,也有在溶液中进行的,其中部分产物已略去。
已知:A是固体单质;B、X、H为气体单质,D属于可溶于水的强电解质,一个D分子中含有18个电子。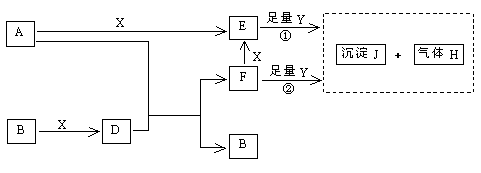
(1)化学式:B为_________,F为_________;
(2)写出D的电子式_________,液态D能否导电_________(填“能”或“否”);
(3)A是一种非常重要的工业产品。据统计,地球上每年由于腐蚀而消耗的A约占A年产量的10%。A发生腐蚀的主要原因是(填写下面的选项序号)_________;
a.直接与氧气发生化学腐蚀 b.通过原电池反应发生腐蚀 c.因溶于水而消耗掉
若你选定选项a或c,请写出相应的化学方程式;若你选定选项b,请写出负极的电极反应式:____________________________________________________;
(4)已知H的密度比空气的密度大,则①中所涉及的反应的化学方程式为:
__________________________________,______________________________。
五、(本题包括2小题,共24分)
22.(10分)请根据以下知识解答
![]() (R代表烃基,下同。)
(R代表烃基,下同。)
![]()
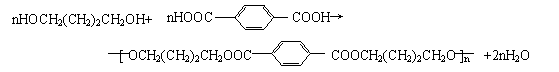
1,4―丁二醇是生产工程塑料PBT(聚对苯二甲酸丁二酯)的重要原料,它可以通过下图两种不同的合成路线制备,请写出相应物质的结构简式:
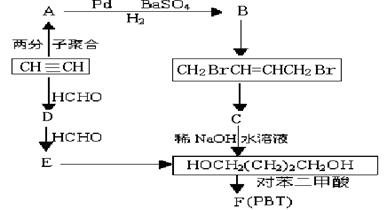
请写出:⑴A和E的结构简式: 、
⑵写出生成CH2BrCH=CHCH2Br的化学反应方程式:
写出生成F (PBT)的化学反应方程式:
⑶某学生研究发现由乙炔可制得乙二醇,请你设计出合理的反应流程图。
![]() 提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
a b c …… 乙二醇
23.(14分)乙烯和乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃后充分反 应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45g水。试求:
(1)CO和CO2混合气体的物质的量=______________,生成的水的物质的量=______________。
(2)当a =1时,乙烯和乙烷的物质的量之比n(乙烯)∶n(乙烷)=______________。
(3)当a =1,且反应后CO和CO2混合气体的物质的量为反应前氧气的2/3时,则b =___________;
得到的CO和CO2的物质的量之比n(CO)∶n(CO2)=______________。
(4)a的取值范围是_____________________;b的取值范围是______________________
六、(本题包括2小题,共17分)
24.(7分)将9.6g铜加入到50mL 12mol·L-1 HNO3溶液中,待铜全部溶解后,剩余溶液的pH=0(忽略溶液体积的变化),产生的气体(含NO、NO2、N2O4)折算成标准状况下的体积为4.48L。请计算:
(1)被还原的硝酸的物质的量。
(2)所得气体中NO、NO2的物质的量。
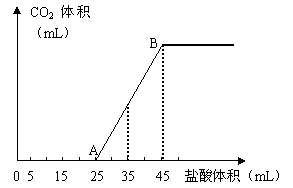
25.(10分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)写出OA段所发生反应的离子方程式________________________________________________
____________________________________________________________。
(2)当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数。
 |
高三化学综合测试答题纸
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
17.___________________________
18.⑴ __________________________________________________
⑵_________________,__________________________________________________
⑶__________________________________________
⑷___________________________________________________,_____________________,
__________________________________________________
⑸________________________________,________________________________________________
_________________________________________________________________________________。
19.(1)__________,____________ (2)__________ (3)__________ (4)__________
20.(1)________________,________________,______________
(2)__________________________________________________
(3)_________________,________________________________________
21.(1)_______________,_______________ (2)_______________,________________
(3)_______,_______________________ (4)_______________,________________
22.⑴ 、
⑵
⑶
23.(1)_________________,__________________。 (2)______________。
(3)___________;______________。 (4)_____________________;______________________。
24.
25.
答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | C | C | B | A | B | C | D |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | BC | D | B | A | D | BD | AC | BC |
17.(4分)1258(错选1题倒扣1分)
18.(15分)⑴ NH4HCO3![]() NH3↑+CO2↑+H2O↑(2分)
NH3↑+CO2↑+H2O↑(2分)
⑵ 碱石灰 , 无水CaCl2只能吸水,不能吸收CO2 (每空1分,共2分)
⑶ 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
(或2Na2O2+2H2O==4NaOH+O2↑); (2分)
⑷ 4NH3+5O2![]() 4NO+6H2O(2分), 放热(每空1分), 反应开始后断开电键K,铂丝能继续保持红热。(2分)(答“吸热,反应开始后断开电键K,铂丝不能继续保持红热”也给分)
4NO+6H2O(2分), 放热(每空1分), 反应开始后断开电键K,铂丝能继续保持红热。(2分)(答“吸热,反应开始后断开电键K,铂丝不能继续保持红热”也给分)
⑸气体颜色变浅 ,(1分)NO2发生反应:2NO2![]() N2O4;△H<0,属于放热反应,达到平衡后,若降低温度,平衡向右移动,NO2浓度减少,N2O4浓度增大,而N2O4无色,所以气体颜色变浅。(共3分,其中方程式占1分,)
N2O4;△H<0,属于放热反应,达到平衡后,若降低温度,平衡向右移动,NO2浓度减少,N2O4浓度增大,而N2O4无色,所以气体颜色变浅。(共3分,其中方程式占1分,)
19.(共10分,每空2分)
(1)向右 减小 (2)小于 (3)大于 (4)小于
20.(共8分)
![]() (1)(3分)O=C=O 极性 非极性
(1)(3分)O=C=O 极性 非极性
.(2)(2分)
(3)(3分) (1分) S2-+H2O![]() HS-+OH-
(2分,多写HS-+H2O
HS-+OH-
(2分,多写HS-+H2O![]() H2S+OH-不扣分)
H2S+OH-不扣分)
21.(8分)(每空1分,共8分)
(1)H2 ![]()
(2)![]() 否
否
(3)b ![]()
(4)![]()
![]()
22.(10分,每空2分)
(1)A.CH≡CCH=CH2 E.CH≡CCH2OH
(2)CH2=CHCH=CH2+Br2→CH2BrCH=CHCH2Br
![]()
⑶CH≡CH CH2=CH2 CH2Br-CH2Br CH2OH-CH2 OH
(其它合理答案也给分)
23.(14分)
(1)2a mol(2分), 2.5mol(2分) (2)1∶1(2分) (3)3(2分) 1∶3(2分)
(4)![]()
![]() <
<![]() <
<![]() (2分)
(2分) ![]() <b<
<b<![]() (2分)
(2分)
24.(7分)(1)反应后的溶液中有Cu(NO3)2和HNO3,因此被还原硝酸的物质的量为
0.050L×12mol·L-1 -0.050L×1mol·L-1 - ![]() = 0.25mol(3分)
= 0.25mol(3分)
(2)设NO、NO2的物质的量分别为x、y,则N2O4的物质的量为0.2mol-x-y
电子得失守恒:3x + y + 2(0.2mol-x-y)= ![]()
N原子守恒:x + y + 2(0.2mol-x-y)= 0.25mol
x = 0.025mol,y = 0.125mol(各2分)
25.(10分)
(1)H+ + OH— = H2O,CO32— + H+ = HCO3— (4分)
(2)224mL(2分)
(3)设碳酸钠、碳酸氢钠和氢氧化钠的物质的量分别为x、y、z,则
![]() x + y = 1mol/L×(0.045-0.025)L
x + y = 1mol/L×(0.045-0.025)L
z - y = 1mol/L×[0.025-(0.045-0.025)]L
84g/mol·x + 106g/mol·y + 40g/mol·z = 2.5g
x=0.01mol,y=0.01mol,z=0.015mol
所以,NaOH的质量为0.6g,Na2CO3的质量分数为![]()
(共4分)