高三十二月月考理综化学试题
可能用到的相对原子质量:C-12 O-16 Na-23 Ba-23
一、选择题(每小题只有一个正确选项,每小题6分,共48分)
6.等物质的量的下列物质分别与足量的NaOH溶液完全反应,需要NaOH的量最多的是( )
A.NaHSO4
B. AlCl3
C. SiO2
D. HO—![]() —OOCCH3
—OOCCH3
7.下表为元素周期表前四周期的一部分,下列有关表中各元素的叙述正确的是( )
| ② | ④ | |||
| ① | ③ | ⑤ | ⑥ | |
| ⑦ | ||||
A.原子半径的大小顺序是①>②>③>④ B.⑤的氢化物的沸点高于④的氢化物
C.工业上冶炼①的单质的方法是还原法 D.⑥的阴离子的还原性比⑦的阴离子强
8.下列反应的离子方程式书写正确的是( )
A.向澄清石灰水中通入过量的二氧化碳:CO2+Ca2++2OH-=CaCO3↓+H2O
B.向稀硝酸中加入过量的铁粉:3Fe+8H++2![]() =3Fe2++2NO↑+4H2O
=3Fe2++2NO↑+4H2O
C.向碳酸氢钠溶液中加入足量的氢氧化钙溶液![]()
D.用铜作阳极,碳棒作阴极电解饱和食盐水:![]()
9.设阿伏加德罗常数为NA,下列叙述正确的是( )
A.在标准状况下,2.24L三氧化硫中含有的分子数为0.1NA
B.0.5 mol NH3中含有5NA个电子
C.25℃时,pH=1的盐酸中约有0.1NAH+
D.在常温常压下,16gO2和O3的混合物中含有的质子数为NA
10.向容积为2L的密闭容器中充入2molX气体和1molY气体,在一定条件下发生如下反应:
![]() 2X(g)+Y(g) 3R(g);经2s后达到平衡,测得R气体的浓度为0.6mol/L。下列说法中错误的是( )
2X(g)+Y(g) 3R(g);经2s后达到平衡,测得R气体的浓度为0.6mol/L。下列说法中错误的是( )
A.用物质X表示该反应在2s内的平均反应速率为0.2 mol/(L·s)
B.平衡时物质X与Y的转化率相等
C.其他条件不变,加压缩小容器体积时平衡不移动,气体密度和平均相对分子质量增大
D.其他条件不变,向容器中再加入1 mol R气体,达到新的平衡后,R的体积分数不变
11.下列反应改变反应物的用量或浓度,其产物不会改变的是( )
A.铜丝在氯气中燃烧 B. SO2通入NaOH溶液
C.甲烷在氧气中燃烧 D. 硫酸中加入锌粉
12.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛运用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:![]() 。则下列叙述正确的是( )
。则下列叙述正确的是( )
A.该反应中N2是还原剂,Al2O3是氧化剂
B.该反应中每生成2mol AlN,N2转移3mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体
13.常温下,向一定浓度的醋酸溶液中逐滴加入氢氧化钠溶液直至过量,在此操作过程中,有关溶液中离子浓度变化的大小关系不正确的是( )
A.当pH=7时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
B.当pH>7时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.当恰好完全中和时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.无论溶液显什么性都有关系:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
26.(16分)A、B、C、D、E五种短周期元素。他们的原子序数依次增大,A元素的原子是半径最小的原子,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同主族,且与E同周期,E元素的最外层电子数是其次外层电子数的![]() 倍。A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物。
倍。A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物。
回答下列问题:
(1)写出元素B、E的元素符号:B____________,E_____________。
 (2)常温下,B元素的最高价氧化物的水化物的水溶液与盐X的水溶液的pH均为5。若用c(H+)1和c(H+)2分别表示这两种水溶液中由水电离出来的H+浓度,则c(H+)1:c(H+)2=____________。
(2)常温下,B元素的最高价氧化物的水化物的水溶液与盐X的水溶液的pH均为5。若用c(H+)1和c(H+)2分别表示这两种水溶液中由水电离出来的H+浓度,则c(H+)1:c(H+)2=____________。
(3)将铝片和镁片用导线相连,插入由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为_________________。
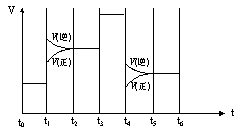
![]() (4)A、B二种元素的气态单质A2和B2在一定条件下发生反应:3A2(g)+B2(g)
2BA3(g);ΔH<0。当反应达到平衡时不断改变体系的条件(不考虑改变A2、B2和BA3的量),右图表示该反应在某一时间段中的反应速率与反应过程的关系,其中表示平衡混合物中BA3的含量最高的一段时间是_____________,t1时刻改变的条件是_____。
(4)A、B二种元素的气态单质A2和B2在一定条件下发生反应:3A2(g)+B2(g)
2BA3(g);ΔH<0。当反应达到平衡时不断改变体系的条件(不考虑改变A2、B2和BA3的量),右图表示该反应在某一时间段中的反应速率与反应过程的关系,其中表示平衡混合物中BA3的含量最高的一段时间是_____________,t1时刻改变的条件是_____。
(5)下列有关合成BA3工业生产的说法中,正确的是______________。
a.向循环气中不断补充A2、B2,并将BA3及时地从混合气体中分离,这样有利于BA3的合成。
b.为了使化学平衡向正反方向移动,所以将反应温度控制在500℃左右。
c.为了增大催化剂的活性,所以一般采用的压强是20MPa-50MPa。
27. (16分)
室温下,A、B、C均为单质,A、B为气体并且A在所有气体中密度最小,C为固体。在合适反应条件下,它们的转化关系如下图所示。请回答:
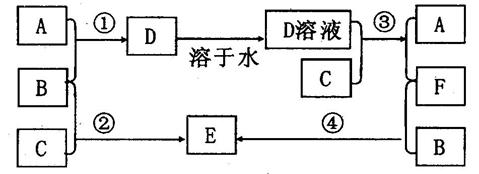
(1)填写有关化学试:A 、C ;
(2)反应②的化学方程式为: ;
(3)用胶头滴管伸入盛有F溶液的试管的底部慢慢加入![]() 溶液,观察到的现象是
溶液,观察到的现象是
。
写出有关反应的化学方程式:
(4)反应④的离子方程式为:
(5)实验室在配制E的溶液时需加入一定量的D溶液,其原因是(结合离子方程式说明)
28.(16分)
为了测定NaOH和Na2CO3固体混合物中Na2CO3的质量分数,甲、乙、丙三个同学分别称取a g固体混合物并设计了如下方案:
(1)甲同学的方案是:将样品溶解于适量水中配成浓溶液,再加入过量氯化钡溶液,过滤、洗涤、烘干,称量得固体b g,则固体混合物中Na2CO3的质量分数为_______(用含a、b的式子表示,不必化简),若Ca2+、Ba2+都可以使![]() 沉淀完全,你认为用BaCl2溶液好还是用CaCl2溶液好。(填序号)__________,理由是: _______________________________________________________
______________________________________________________________________。
沉淀完全,你认为用BaCl2溶液好还是用CaCl2溶液好。(填序号)__________,理由是: _______________________________________________________
______________________________________________________________________。
A.CaCl2溶液 B. BaCl2溶液 C. 一样好
(2)乙同学的方案是:将样品溶解后,加入稍过量的氯化钡溶液,再滴入2-3滴______试液做指示剂,用标准盐酸滴定,乙同学在滴定过程中所需要的主要玻璃仪器有_________________________
_______________________________________________________________________。
(3)丙同学的方案如图12所示:
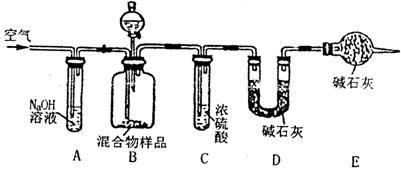
当混合物样品充分反应时,缓慢通入空气的目的是____________________________,上图中装置B的分液漏斗中应加入的试剂最好是(填名称)______________;如果没有E装置,测定结果会____________(填“偏大”或“偏小”或“不影响”)。
29.(12分)丙酸丙酯是一种香料,可以用下面的设计方案合成:
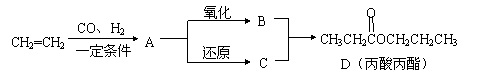 |
(1) A的结构简式为 。
(2)写出下列反应的化学方程式:
①A——→C
②D+NaOH——→
(3)D有很多同分异构体,在含有羧基的同分异构体中,烃基上一氯取代物有2种的同分异构体的结构简式是 。
参考答案及评分标准
一、选择题(每小题6分,共48分)
6. B 7. C 8. B 9、B 10. C 11.A 12. C 13、B
26.(共16分)
(1)N(2分)、S(2分)
(2)10-4(2分)
(3)Al-3e-+4OH-=AlO2-+2H2O(3分)
(4)t0-t1(3分) 升高温度(2分)
(5)a(2分)
27. (16分)
(1)![]() (1分) Fe ( 1分)
(1分) Fe ( 1分)
(2)![]() (2分)
(2分)
(3)生成白色絮状沉淀,并迅速变成灰绿色。最后变为红褐色;(2分)
![]() (2分)
(2分)
4![]() (2分)
(2分)
(4)![]() (2分)
(2分)
![]() (5)
(5)![]() 是强酸弱碱盐,易发生如下水解;Fe3++3H2O Fe(OH)3+3H+,(2分)加入一定量的盐酸后由于
是强酸弱碱盐,易发生如下水解;Fe3++3H2O Fe(OH)3+3H+,(2分)加入一定量的盐酸后由于![]() 浓度增加,使平衡向逆反应方向移动,可有效抑制水解。(2分)
浓度增加,使平衡向逆反应方向移动,可有效抑制水解。(2分)
28.(每空2分,共16分)
(1)![]() ; B; 因Ca(OH)2微溶,加入CaCl2后会使CaCO3沉淀中混入Ca(OH)2而影响测定结果;相同量的
; B; 因Ca(OH)2微溶,加入CaCl2后会使CaCO3沉淀中混入Ca(OH)2而影响测定结果;相同量的![]() 生成的CaCO3比Ba CO3的质量少,误差更大。
生成的CaCO3比Ba CO3的质量少,误差更大。
(2)酚酞 酸式滴定管,锥形瓶;
(3)使B装置中反应生成的CO2全部排出(2分); 稀硫酸; 偏大。
29.(每空3分,共12分)
 (1)CH3CH2CHO
(1)CH3CH2CHO
(2)①CH3CH2CHO+H2 CH3CH2CH2OH

②CH3CH2COOCH2CH2CH3 + NaOH △ CH3CH2COONa + CH3CH2CH2OH
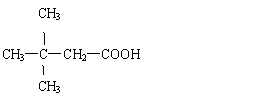 |
(3)