高三年级化学上册第三次月考试题
化 学 试 卷
命题、审核:常国福
可能用到的相对原子质量:H: 1、C :12、N: 14、O :16、Si;28
第Ⅰ卷(选择题,共48分)
一、选择题(每题3分,共48分,每小题只有一个选项正确)
1、能源危机是制约现代社会发展的严重问题,开发和利用新能源是中国立足自身解决能源困扰的重要举措之一。背景材料:①2005国际油价飙升,新型纳米金属燃料面世;②2006年1月1日,“苏北五市”全面推广使用乙醇汽油;③到2010年,全国打造多个最重要的太阳能产业基地;④生物柴油是以油脂为原料,通过水解、酯化所得高级脂肪酸甲酯。下列说法正确的是
A.乙醇汽油的推广使用大大了降低国际市场的油料价格
B.生物柴油燃烧不会产生二氧化碳,是一种清洁能源
C.太阳能是一种清洁安全的不可再生能源
D.纳米金属燃料表面积大,易引发,能量释放快
2 .红色信号弹的主要成分为KClO3、Sr(NO3)2、Mg粉、聚氯乙烯组成,而红色发光剂的主要成分为Sr(NO3)2、Mg粉、Al粉。由此可判断产生红焰色的元素是( )
A. Mg B. Sr C. K D. Cl
3 .铅笔是常用的学习用品,铅笔芯的主要成分是石墨和黏土。某型号的铅笔芯质量的一半成分是石墨,用该铅笔写一个化学方程式消耗的质量约1mg,那么铅笔芯中减少的碳原子数约为( )
A.2.5×1019个 B.2.5×1022个 C.5×1019个 D.5×1022个
4、不具有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法中正确的是
A.34S原子核内的中子数为16 B.1H216O在相同条件下比1H218O更易蒸发
C.13C和15N原子核内的质子数相差2 D.2H+的酸性比1H+的酸性更强
5、下列有关物质的结构或性质的叙述错误的是
A.由极性键形成的分子不一定是极性分子
B.水是一种非常稳定的化合物,这是由于氢键所致
C.石英、食盐、金属钠、干冰的熔点依次降低
D.分子晶体中一定存在分子间作用力,可能有共价键
6.某气体能使紫色石蕊试液变红,能使酸性高锰酸钾溶液褪色,若通入溴水,可使溶液变浑浊。该气体是
A.CO2 B.CI2 C.H2S D.SO2
7.(CN)2的结构式为N≡C—C≡N,性质与卤素单质相似,下列有关(CN)2的说法中正确的是
A.NaCN与AgCN都易溶于水
B.不与氢氧化钠溶液反应
C.可用NaCN、浓H2SO4、MnO2共热制得(CN)2
D.C≡N的键长大于C—C键键长
8.下列实验操作中,正确的是
A.将氢氧化钠固体放在滤纸上称量
B.用10mL量筒量取8.58mL蒸馏水
C.制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集
D.配置氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度
9.大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质。后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高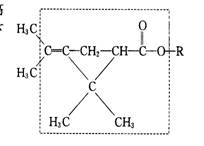 效、低毒、对昆虫有强列触杀作用的杀虫剂。对此杀虫剂的下列叙述中,错误的是
效、低毒、对昆虫有强列触杀作用的杀虫剂。对此杀虫剂的下列叙述中,错误的是
A.能发生加氢反应,但其生成物无杀虫作用
B.在酸性溶液中,此类杀虫剂将会失去杀虫作用
C.此类杀虫剂密封保存在碱溶液中,其杀虫作用不变
D.左端的甲基(—CH3)可被取代,其产物仍有杀虫作用
10、100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)
![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①烧瓶内气体的颜色不再加深,②N2O4的消耗速率与NO2的生成速率之比为1∶2,③NO2的生成速率与NO2消耗速率相等,④NO2的物质的量浓度不变,⑤烧瓶内气体的质量不再变化,⑥烧瓶内气体的压强不再变化,⑦烧瓶内气体的密度不再变化,⑧烧瓶内气体平均相对分子质量不再变化
A.②⑤⑦ B.①③④⑥⑧ C.只有③ D.只有⑤
11、通常状况下,前者一定大于后者的是
A.物质的量浓度相等的次氯酸钠溶液和醋酸钠溶液的pH
B.25℃的纯水和100℃的纯水中的c(H+)
C.硫酸铵溶液和氯化铵溶液中c(NH4+)
D.读取量筒中一定体积的液体时,仰视的读数和俯视的读数
12、三硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子的最外层均已达到了8个电子的结构。在一个三硫化四磷分子中含有的共价键个数是
A.7个 B.9个 C.19个 D.不能确定
13.下列反应的离子方程式书写正确的是
A.金属钠与水反应:Na +H2O===Na+ +OH- +H2↑
B.Fe2(SO4)3的酸性溶液中通入足量H2S :Fe3+ +2H2S===FeS +S↓ + 4H+
C.将0.4mol铁粉逐渐加入到200mol 4 mol / L的稀硝酸中:
3Fe + 8H+ +2NO3-===3Fe2+ + 2NO ↑+ 4H2O
D.Al2(SO4)3溶液中加入过量氨水:Al3+ + 3OH—===Al(OH)3↓
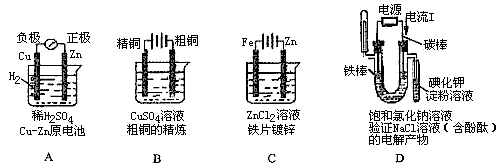
14. 下列有关电化学的图示中,完全正确的是
15.下列各组物质,可用一种试剂加以区别的是
①四种黑色固体:FeO、Fe、CuO、C
②四种白色粉末:(NH4)2SO4、NH4CI、Na2SO4、NaCI
③四种无色溶液:乙醛、乙酸、甲酸、乙醇
④四种有机物:苯、四氯化碳、乙烯、无水乙醇
A.只有①② B.只有③④ C.只有①②④ D.全部
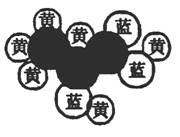 16、下图是一种有机物的比例模型,该模型代表的有机物可能是( )
16、下图是一种有机物的比例模型,该模型代表的有机物可能是( )
A、饱和一元醇 B、羧酸酯
C、羟基羧酸 D、饱和一元醛
高三年级化学上册第三次月考试题
化 学 试 卷
命题、审核:常国福
选择题答题卡:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共52分)
二、(本题包括两小题,共12分)
17 、Ⅰ(2分)在实验室进行的下列实验中,有关仪器的下端必须插入液面以下的是 (填编号)。
①分馏石油时用的温度计 ②制备乙烯时用的温度计
③用水吸收溴化氢的导管口 ④用碱液吸收多余氯气的导管口
⑤制备H2的简易装置中加入稀硫酸用的长颈漏斗
⑥制备Fe(OH)2时,向FeSO4溶液中滴入NaOH溶液用的胶头滴管
Ⅱ(10分)某兴趣小组在研究性学习中设计了如下实验来探究Fe与H2SO4反应的过程,装置如下图所示。实验步骤:①在试管中加入80% H2SO4;②将提拉式铁丝插入溶液中,观察到先有少量气泡,后停止的现象;③加热试管至有较多量气体产生时停止加热,品红试液颜色褪去试管中溶液变为棕黄色。④一段时间后KMnO4/H+溶液颜色不再变浅,但NaOH溶液中仍有气泡逸出,在导管口处可以点燃该气体,试管中液体变为浅绿色。根据以上实验回答: 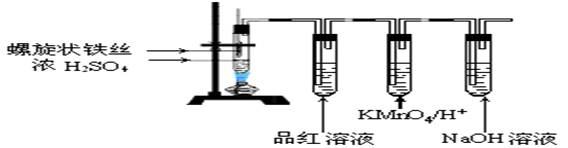 (1)在步骤②中现象说明
;
(1)在步骤②中现象说明
;
(2)在步骤③中,品红褪色的原因是 ;
(3)写出步骤④中,使溶液变为浅绿色的可能原因(用离子方程式表示)
;
;
(4)设计实验证明反应后的溶液中有Fe2+:
。
三、(本题包括两小题,共12分)
18、Ⅰ、(8分)有A、B、C、D、E、F、G、W八种气体,进行如下实验:
(1)分别将八种气体通入水中发现E、F难溶于水,其它气体可溶,其中A、D极易溶于水,W溶于水时有F气体生成
(2)A经催化氧化得F,C在空气中充分燃烧可得G
(3)C、D遇酸化的硝酸银分别有黑色沉淀和白色沉淀生成
(4)B与E化合得D,D与A相遇有大量白烟生成;
则:A的电子式 ,B的化学式 ,C的分子构型为
D的晶体属于 ,E的结构式 ,
F使人中毒的原因 ,
G对环境的危害是 ,
W与水反应的方程式 ;
Ⅱ、(4分 )光导纤维是由地球上含量最多的两种元素(A、B)所组成,A元素所含质子数与B元素所含质子数之比为7 :4,光导纤维晶体中只有一种共价键。根据上述叙述,试推出:
⑴ A元素的名称 ,它在周期表中的位置是 (周期、族)。
⑵ B元素的电子式为 。
⑶ 光导纤维晶体跟氢氧化钠共热,可得到俗称水玻璃的化合物,反应的离子方程式是 。
四 、(本题包括两小题,共16分)
19、Ⅰ(6分)近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质---碳纳米颗粒.这种碳纳米颗粒可用氧化汽化法提纯.其反应的化学方程式为:
__C + __K2Cr2O7 + __H2SO4(稀)![]() __CO2 + __K2SO4 + __Cr2(SO4)3
+ __ ____
__CO2 + __K2SO4 + __Cr2(SO4)3
+ __ ____
(1) 完成并配平上述反应的化学方程式
(2) 此反应的氧化剂__________,氧化产物是__________.
(3) H2SO4在上述反应中表现出来的性质是__________(填选项编号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应中若产生11g气体物质,则转移电子的数目为____________.
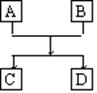 Ⅱ(10分)已知A、B、C、D的组成元素都属于短周期,其中A、D为单质,B、C为化合物,它们之间的简单转化关系如图所示。请按要求写出有关化学反应式,是离子反应的只写离子方程式:
Ⅱ(10分)已知A、B、C、D的组成元素都属于短周期,其中A、D为单质,B、C为化合物,它们之间的简单转化关系如图所示。请按要求写出有关化学反应式,是离子反应的只写离子方程式:
(1)若A、D的组成元素同主族:
①B是水:_________________________________________ _。
②B、C均为氧化物(反应有重要的工业价值):
_________________________ _ _,工业价值是:_____________。
(2)若A、D的组成元素不同主族:
①B是水且水是还原剂:________________________________________ ;
B是水且水是氧化剂(反应有重要的工业价值):
工业价值是: 。
②B、C均为氧化物且B不是水:________________________________________。
五、(本题共12分)
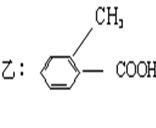
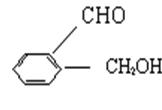
20、今有化合物
 | |||||
 | |||||
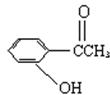 | |||||
甲: 丙
(1)请写出丙中所含官能团的名称: 。
(2)请判别上述哪些化合物互为同分异物构: 。
(3)请分别写出鉴别甲、乙、丙化合物的方法(指明所选试剂及主要现象即可)。
鉴别甲的方法:
。
鉴别乙的方法:
。
鉴别丙的方法:
。
(4)请按酸性由强至弱排列甲、乙、丙的顺序: 。
化学参考答案
选择题答题卡:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | B | A | B | B | C | C | D | C | A | A | B | C | D | D | C |
17.(12分 )
Ⅰ、②④⑤⑥(2分)
Ⅱ(1)常温下Fe在80%的H2SO4溶液中可以发生钝化;
(2)生成的SO2气体具有漂白性;
(3)Fe+2H+=Fe2++H2↑; Fe+2Fe3+=3Fe2+ (方程式无先后)
(4)取少许所得溶液加入KSCN不变色,再加入氯水后变成红色,说明原溶液中含有Fe2+(其他合理设计也给分)。(每空2分)
18、(12分)
Ⅰ、(每空1分)
..
A 、H:N:H B、CL2 C、V型结构 D、分子晶体 E、H-H
H
F、与血红蛋白结合,使血红蛋白失去输送氧的能力。(使血红蛋白中毒)
G、污染大气,形成酸雨。W、3NO2 + H2O == 2HNO3 + NO
Ⅱ (4分)
⑴ (2分) 硅 、 第三周期 IVA
⑵ (1分) :O:
⑶ (1分)![]()
19.(16分)
Ⅰ(6分)
⑴(2分)
(3)C + (2) K2Cr2O7 + (8)H2SO4——(3)CO2 + (2)K2SO4 +(2) Cr2(SO4)3 + (8) H2O
⑵(2分) K2Cr2O7 、 CO2
⑶ (1分)A
⑷ (1分)6.02×1023 或 1mol
Ⅱ(10分)(1)①2Na+2H2O=2Na++2OH-+H2↑(2分)(写化学方程式得1分)
②2C+SiO2![]() Si+2CO↑(2分),生产粗硅(1分),
Si+2CO↑(2分),生产粗硅(1分),
⑵①2F2+2H2O=4HF+O2(2分),C+H2O![]() CO+H2(2分),生产水煤气(1分),
CO+H2(2分),生产水煤气(1分),
②2Mg+CO2![]() 2MgO+C(2分)
2MgO+C(2分)
20、(12分)(每空2分)
(1)醛基、羟基
(2)甲、乙、丙互为同分异构
(3)与三氯化铁溶液作用显色的是甲
与碳酸钠溶液作用有气泡生成的是乙
与银氨溶液共热会发生银镜反应的是丙。
(4)乙>甲>丙